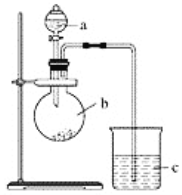
题目内容
【题目】能证明铝的金属性比镁弱的实验事实是( )
A.镁与冷的浓硫酸反应,铝与冷的浓硫酸不反应
B.铝的原子半径比镁小
C.Al(OH)3能溶于NaOH溶液,而Mg(OH)2不能
D.银的金属光泽不如镁显著
【答案】C
【解析】
A.铝遇浓硫酸发生钝化,是铝的特性,不能用于比较金属性的强弱,A无法证明;
B.原子半径的大小一般不能直接说明金属性的强弱,B无法证明;
C.最髙价氧化物对应水化物的碱性越强,其金属性越强,Al(OH)3能跟NaOH反应体现其两性,而Mg(OH)2是中强碱,故Mg比A1活泼,C可以证明;
D.物理性质如金属光泽等,不能用于比较金属性的强弱,D无法证明。
答案为C。

【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由物质的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3对比得出的结论是______________________________。
(2)我们最好选取实验________(填3个实验序号)研究锌的形状对反应速率的影响。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
(4)利用表中数据,可以求得:硫酸的物质的量浓度是________mol/L。
Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
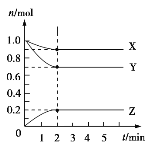
(5)反应开始至2 min,Y的平均反应速率______________________。
(6)分析有关数据,写出X、Y、Z的反应方程式_________________。
【题目】已知:1 mol晶体硅中含有2 mol Si—Si键。工业上可通过下列反应制取高纯硅:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )
Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
A.+412 kJ·mol-1 B.-412 kJ·mol-1
C.+236 kJ·mol-1 D.-236 kJ·mol-1