题目内容
【题目】(1)工业上利用N2和H2合成NH3,NH3又可以进一步制备联氨(N2H4)等。由NH3制备N2H4的常用方法是NaClO氧化法,其离子反应方程式为___________,有学者探究用电解法制备的效率,装置如图,试写出其阴极电极反应式__________________;

(2)某种铅酸蓄电池具有廉价、长寿命、大容量的特点,它使用的电解质是可溶性的甲基磺酸铅,电池的工作原理:Pb+PbO2+4H+![]() 2Pb2++2H2O充电时,阳极的电极反应式为_________;
2Pb2++2H2O充电时,阳极的电极反应式为_________;
(3)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇(CH3CH2OH)的一种反应原理为:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H=-akJ/mol
CH3CH2OH(g)+H2O(g) △H=-akJ/mol
己知:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-bkJ/mol
CO2(g)+H2(g) △H=-bkJ/mol
以CO2(g)与H2(g)为原料也可合成乙醇,并放出热量,写出该反应的热化学反应方程式:___________。
(4)如图是一个电化学过程的示意图。

请回答下列问题:
![]() 写出通入CH3OH的电极的电极反应式______。
写出通入CH3OH的电极的电极反应式______。
②乙池中C棒电极反应的方程式为__________________,当乙池中B极质量增加10.8g,此时丙池中析出3.2g某金属,则丙池中的某盐溶液可能是______(填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
【答案】2NH3+ClO- =N2H4+H2O + Cl- O2+4e-=2O2- Pb2++2H2O-2e- =PbO2+4H+ 2CO2(g)+6H2(g)=C2H5OH(g)+3H2O(g) △H=-(a-2b) kJ/mol CH3OH-6e-+8OH-=CO32-+6H2O 2H2O-4e-=O2↑+4H+ BD
【解析】
根据装置特点判断是原电池还是电解池,根据原电池和电解池原理分析正负极和阴阳极并书写对应的电极反应式;根据盖斯定律书写热化学方程式;根据二次电池的总反应,书写电极反应;根据闭合回路中电子转移守恒计算电极产物的量。
(1)根据题干信息知NH3被NaClO氧化生成N2H4,NaClO被还原生成Cl-,离子方程式为:2NH3+ClO- =N2H4+H2O + Cl-;根据电解装置分析知,阴极发生还原反应,元素化合价降低,装置中左侧为阴极,氧气得电子生成氧离子,电极反应为:O2+4e-=2O2-,故答案为:2NH3+ClO- =N2H4+H2O + Cl-;O2+4e-=2O2-;
(2)根据Pb+PbO2+4H+![]() 2Pb2++2H2O分析得,充电时,阳极失电子,发生氧化反应,元素化合价升高,则电极反应式为:Pb2++2H2O-2e- =PbO2+4H+;
2Pb2++2H2O分析得,充电时,阳极失电子,发生氧化反应,元素化合价升高,则电极反应式为:Pb2++2H2O-2e- =PbO2+4H+;
(3)根据盖斯定律得:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) △H1=-akJ/mol I,CO(g)+H2O(g)
CH3CH2OH(g)+H2O(g) △H1=-akJ/mol I,CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-bkJ/mol II,I-2×II得:2CO2(g)+6H2(g)=C2H5OH(g)+3H2O(g) △H=△H1-2△H2=-(a-2b) kJ/mol;
CO2(g)+H2(g) △H2=-bkJ/mol II,I-2×II得:2CO2(g)+6H2(g)=C2H5OH(g)+3H2O(g) △H=△H1-2△H2=-(a-2b) kJ/mol;
(4)![]() 根据图示,甲池为甲醇燃料电池,通入甲醇的电极为负极,发生氧化反应,因为电解质为KOH,所以氧化产物为碳酸钾,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;
根据图示,甲池为甲醇燃料电池,通入甲醇的电极为负极,发生氧化反应,因为电解质为KOH,所以氧化产物为碳酸钾,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;
②乙池为电解池,C棒连接电池的正极,阳极失电子发生氧化反应,根据放电顺序,水失电子生成氧气和氢离子,电极反应的方程式为: 2H2O-4e-=O2↑+4H+;乙池中B极反应为Ag++e-=Ag,质量增加10.8g,则转移电子数为![]() =0.1mol;丙池某电极析出3.2g金属,说明丙池中电解质是含有氧化性较强的金属阳离子在阴极得电子析出金属,不可能是镁离子和钠离子的盐溶液,则AC错误;此时转移电子为0.1mol,若是二价金属,金属的摩尔质量是
=0.1mol;丙池某电极析出3.2g金属,说明丙池中电解质是含有氧化性较强的金属阳离子在阴极得电子析出金属,不可能是镁离子和钠离子的盐溶液,则AC错误;此时转移电子为0.1mol,若是二价金属,金属的摩尔质量是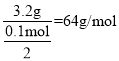 ,所以电解质是含有铜离子的盐溶液,则B正确;若是一价金属,金属的摩尔质量是32g/mol,但题目中没说丙池盐溶液足量,若AgNO3不足,只能电解出3.2gAg,之后一直电解水,所以D正确,故答案为:2H2O-4e-=O2↑+4H+;BD。
,所以电解质是含有铜离子的盐溶液,则B正确;若是一价金属,金属的摩尔质量是32g/mol,但题目中没说丙池盐溶液足量,若AgNO3不足,只能电解出3.2gAg,之后一直电解水,所以D正确,故答案为:2H2O-4e-=O2↑+4H+;BD。

【题目】一定温度下,在3个容积均为![]() 的恒容密闭容器中反应
的恒容密闭容器中反应![]() 达到平衡,下列说法正确的是
达到平衡,下列说法正确的是
容器 | 温度 | 物质的起始浓度 | 物质的平衡浓度 | ||
|
|
|
| ||
Ⅰ | 400 |
|
| 0 |
|
Ⅱ | 400 |
|
| 0 |
|
Ⅲ | 500 |
|
| 0 |
|
A. 该反应的正反应是吸热反应
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的小
C. 达到平衡时,容器Ⅱ中![]() 小于容器Ⅲ中
小于容器Ⅲ中![]()
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小







