题目内容
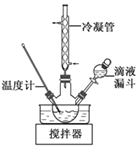
【题目】下图是实验室对煤进行干馏的装置图,回答下列问题:

(1)指出图中仪器名称:c______,d______。
(2)仪器d的作用是______,c中液体有______和______,其中无机物里溶有_____,可用_____检验出来。有机物可以通过______的方法使其中的重要成分分离出来。
(3)e处点燃的气体的主要成分有_______,火焰的颜色为_______。
【答案】(1)酒精喷灯 烧杯
(2)盛装冷水对蒸气进行冷却 粗氨水 煤焦油 氨 酚酞溶液 分馏
(3)H2、CH4、CH2=CH2、CO 淡蓝色
【解析】
根据煤干馏的主要产品,b中得到的应是焦炭,c中得到的应是粗氨水和煤焦油,e处点燃的应是焦炉气。其中粗氨水中溶有氨,呈碱性,可用酚酞溶液等检验;煤焦油主要是苯、甲苯、二甲苯的混合物,应用分馏的方法分离;焦炉气的主要成分有CH4、CO、H2、CH2=CH2,燃烧时呈淡蓝色火焰。
(1)根据仪器的构造可知,仪器c为U形管;仪器d为烧杯;
(2)仪器d的作用是盛装冷水对蒸气进行冷却,c中液体有粗氨水和煤焦油,其中无机物里溶有近,可用酚酞溶液检验出来。有机物可以利用沸点的不同通过蒸馏(或分馏)的方法使其中的重要成分分离出来;
(3)e处点燃的气体的主要成分有H2、CH4、C2H4、CO,火焰的颜色为淡蓝色。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目