题目内容
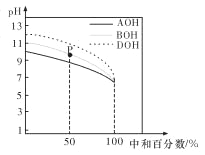
【题目】研究反应2X(g)![]() Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(molL-1)随反应时间(min)的变化情况如图所示。
Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(molL-1)随反应时间(min)的变化情况如图所示。
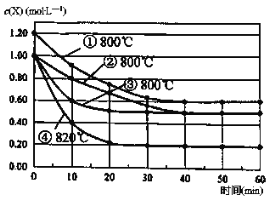
下列说法不正确的是
A. 比较实验②、④得出:升高温度,化学反应速率加快
B. 比较实验①、②得出:增大反应物浓度,化学反应速率加快
C. 若实验②、③只有一个条件不同,则实验③使用了催化剂
D. 在0~10min之间,实验②的平均速率v(Y)=0.04molL-1min-1
【答案】D
【解析】A. X的起始浓度相等,温度升高,化学反应速率加快;B. 实验温度相同,随着反应物X的浓度增大,化学反应速率加快;C.其它条件下不变,催化剂能够加快反应速率;D.根据方程式中物质化学系数关系,根据v(Y)=C/t进行计算。
实验②、④两组实验,X的起始浓度相等,温度由第②组实验的800℃升高到820℃,反应速率明显加快,说明温度升高,化学反应速率加快,A正确。从图像可以看出,实验①、②两组实验温度相同,随着反应物X的浓度增大,化学反应速率加快,B正确;实验②、③,X的起始浓度相等,温度相同,平衡状态也相同,但是实验③反应速率快,到达平衡的时间短,说明实验③使用了催化剂,C正确;从图像可以直接求得0~10min之间实验②的平均速率:(1-0.8)/10=0.02 molL-1min-1,则根据化学方程式的计量数关系可知:v(Y)=0.01 molL-1min-1,D错误;正确选项D。

练习册系列答案
相关题目