题目内容
【题目】下列关于物质的用途说法不正确的是
A.碳酸氢钠可被用于治疗胃酸过多B.Cl2可被用于工业制漂粉精
C.明矾可用于自来水的杀菌消毒D.Fe2O3俗称铁红,常用作红色涂料
【答案】C
【解析】
A.NaHCO3能与盐酸反应生成氯化钠、水和二氧化碳,且碱性较弱,能用来治疗胃酸过多症,故A正确;
B.工业制备漂白粉是利用氯气和石灰乳反应生成氯化钙、次氯酸钙和水,工业制漂粉精:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,故B正确;
C.明矾只能净水,不能消毒,通常用氯气或二氧化氯来对自来水消毒,故C错误;
D.氧化铁呈红棕色,俗称铁红,可以作红色油漆和涂料,故D正确;
故选:C。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
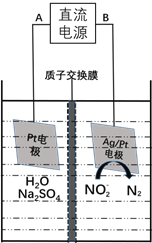
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。