题目内容
【题目】钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等领域。
(1)Ti的基态原子的电子排布式为________。
(2)已知TiC在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原TiO2制取TiC: TiO2+3C![]() TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________;根据所给信息,可知TiC是________晶体。
TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________;根据所给信息,可知TiC是________晶体。
(3)钛的化合物TiCl4,熔点为-24℃,沸点为136.4℃,常温下是无色液体,可溶于甲苯和氯代烃。
①固态TiCl4属于________晶体,其空间构型为正四面体,则钛原子的杂化方式为__________。
②TiCl4遇水发生剧烈的非氧化还原反应,生成两种酸,反应的化学方程式为_________
③用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的配合物[TiCl(H2O)5]Cl2·H2O.该配合物中含有化学键的类型有_________、__________。
(4)钛的一种氧化物是优良的颜料,该氧化物的晶胞如右图所示:

该氧化物的化学式为________;在晶胞中Ti原子的配位数为_______,若晶胞边长为a nm,NA为阿伏伽德罗常数的数值,列式表示氧化钛晶体的密度:___________g/cm3。
【答案】 1s22s23s23p63d24s2(或[Ar]3d24s2) O>C>Ti 原子 分子 sp3 TiCl4+3H2O=H2TiO3+4HCl 共价键 离子键 TiO2 6 ![]()
【解析】(1)Ti的质子数是22,基态原子的电子排布式为1s22s23s23p63d24s2(或[Ar]3d24s2)。(2)非金属性越强,电负性越大,则该反应中涉及的元素按电负性由大到小的顺序排列为O>C>Ti;根据所给信息TiC在碳化物中硬度最大,这说明TiC是原子晶体。(3)①钛的化合物TiCl4,熔点为-24℃,沸点为136.4℃,因此固态TiCl4属于分子晶体,其空间构型为正四面体,则钛原子的杂化方式为sp3。②TiCl4遇水发生剧烈的非氧化还原反应,生成两种酸,根据原子守恒应该是盐酸和钛酸,反应的化学方程式为TiCl4+3H2O=H2TiO3+4HCl;③配合物[TiCl(H2O)5]Cl2·H2O中含有化学键的类型有离子键和共价键。(4)氧原子个数=4×1/2+2=4,Ti原子个数=1+8×1/8=2,所以该氧化物的化学式为TiO2;在晶胞中Ti原子的配位数为6。若晶胞边长为a nm,NA为阿伏伽德罗常数的数值,氧化钛晶体的密度=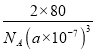 g/cm3。
g/cm3。

 应用题作业本系列答案
应用题作业本系列答案