题目内容
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题:
(1)C、N、O的电负性由大到小的顺序为_________________,基态Fe原子的价电子排布图为________________。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是__________,与CO互为等电子体的分子的电子式为_________________。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是_____________,配体中提供孤对电子的原子是___________________________________。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有_______________形成。
a.离子键 b.配位键 c.非极性键 d.б键
(5)NaAlH4晶体的晶胞如图 ,与Na+紧邻且等距的AlH4-有___________个;NaAlH4晶体的密度为_________g·cm-3(用含a的代数式表示)。
,与Na+紧邻且等距的AlH4-有___________个;NaAlH4晶体的密度为_________g·cm-3(用含a的代数式表示)。
【答案】 O>N>C(1分) ![]() 分子晶体
分子晶体 ![]() sp2、sp3 N bd 8
sp2、sp3 N bd 8 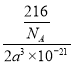 (或“
(或“![]() ”)
”)
【解析】(1)同一周期元素,元素电负性随着原子序数增大而增大,这三种元素第一电离能大小顺序是O>N>C;Fe原子3d、4s能级电子为其价电子,基态Fe原子的价电子排布图为![]() ;(2)熔沸点较低的晶体为分子晶体,Fe(CO)5又名羰基铁,常温下为黄色油状液体,其熔沸点较低,为分子晶体;与CO互为等电子体的分子是氮气分子,电子式为
;(2)熔沸点较低的晶体为分子晶体,Fe(CO)5又名羰基铁,常温下为黄色油状液体,其熔沸点较低,为分子晶体;与CO互为等电子体的分子是氮气分子,电子式为![]() ;(3)该配合物中C原子价层电子对个数是4和3且不含孤电子对,根据价层电子对互斥理论确定C原子杂化方式为sp3、sp2,该配体中Cu原子提供空轨道、N原子提供孤电子对;(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有Cu原子和N、C原子之间的配位键且也是δ键生成,答案选bd;(5)根据均摊法可知,晶胞中AlH4-数目为1+8×1/8+4×1/2=4,Na+数目为6×1/2+4×1/4=4,则二者配位数为1:1,以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,则与Na+紧邻且等距的AlH4-有8个;晶胞质量为4×54/NAg,晶胞密度为
;(3)该配合物中C原子价层电子对个数是4和3且不含孤电子对,根据价层电子对互斥理论确定C原子杂化方式为sp3、sp2,该配体中Cu原子提供空轨道、N原子提供孤电子对;(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有Cu原子和N、C原子之间的配位键且也是δ键生成,答案选bd;(5)根据均摊法可知,晶胞中AlH4-数目为1+8×1/8+4×1/2=4,Na+数目为6×1/2+4×1/4=4,则二者配位数为1:1,以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,则与Na+紧邻且等距的AlH4-有8个;晶胞质量为4×54/NAg,晶胞密度为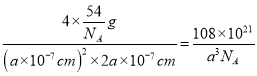 gcm-3。
gcm-3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案