题目内容
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法不正确的是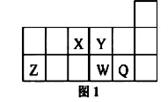
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.Z的氧化物能与水反应 |
| C.离子Y2-和Z 3+的核外电子数和电子层数都相同 |
| D.元素Y的氢化物的稳定性比W的氢化物强 |
B
解析试题分析:根据元素周期表可推知:Q为Cl元素、Y为O元素、W为S元素、X为N元素、Z为Al元素,氧化铝不溶于水,所以B不正确。
考点:元素周期律、元素推断。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是
| A.②、⑧、⑨对应简单离子半径依次减小 |
| B.⑥的氯化物的熔点比⑦的氯化物熔点低 |
| C.元素⑩处于常见周期表第四周期第VIIIB族 |
| D.①分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
已知第三周期元素M,其原子最外层达到饱和时所需的电子数小于次外层与最内层电子数之差,且等于最内层电子数的正整数倍。下列关于元素M的说法一定错误的是
| A.M元素存在同素异形体 |
| B.M元素为非金属元素 |
| C.M的最高价氧化物对应的水化物都是强酸 |
| D.常温下,能稳定存在的M的氧化物都是酸性氧化物 |
卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是
| A.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深 |
| B.卤化氢的键长按H—F、H—C1、H—Br、H—I的顺序依次减小 |
| C.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱 |
| D.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易 |
下表是元素周期表的一部分,有关说法不正确的是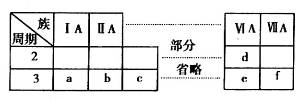
| A.元素e的氧化物对应的水化物均为强酸 |
B.a、b、d、e四种元素的离子半径: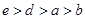 |
| C.b、f两种元素形成的化合物为离子化合物 |
| D.a、c、e的最高价氧化物对应的水化物之间能够相互反应 |
下列排列顺序不正确的是
| A.热稳定性:H2O>NH3>PH3 | B.原子半径:Si>Na>O |
| C.碱性:CsOH>KOH>NaOH | D.失电子能力:K>Na>Mg |
如图是元素周期表的一部分,下列关系正确的是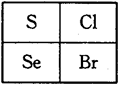
| A.还原性:Se2->S2->Cl- |
| B.热稳定性:HCl>H2Se>HBr |
| C.原子半径:Se>Cl>S |
| D.酸性:HBrO4>HClO>H2SO4 |
X、Y、Z、W四种短周期主族元素的原子序数依次增大,X在短周期中原子半径最大,Y是地壳中含量最高的金属元素,Z的最高正化合价与最低负化合价的代数和为4。下列说法正确的是( )
| A.气态氢化物的稳定性:Z<W |
| B.X与W形成的化合物中含有共价键 |
| C.最高价氧化物对应水化物的碱性:X<Y |
| D.Y的氧化物不能与X的最高价氧化物的水化物发生反应 |