题目内容
11.某化肥厂用NH3为原料制取硝酸,再进一步制取NH4NO3.已知:由NH3制取HNO3时的产率为88%;由NH3与HNO3反应生成NH4NO3的产率为98%.若用100t NH3制取硝酸铵.则(1)用于制硝酸的氨的质量为多少吨?
(2)可制得硝酸铵多少吨?
分析 (1)设与硝酸反应制备硝酸铵的氨气的质量为xt,用于制取硝酸的氨气与剩余氨气的量应该相等,结合氨气制备硝酸的产率计算出用于制硝酸的氨的质量;
(2)根据反应关系式及由NH3与HNO3反应生成NH4NO3的产率、氨气的质量进行计算生成硝酸铵的质量.
解答 解:(1)设100tNH3中制取HNO3的NH3有xt,制成HNO3后剩余的NH3与HNO3按照物质的量1:1反应;
而x吨NH3中只有0.88xt的NH3能有效转化为HNO3,即:0.88x=100-x,解得:x=53.2t,
与HNO3反应生成NH4NO3的NH3为:100t-53.2t=46.8t,
答:用于制硝酸的氨的质量为53.2t;
(2)氨气生成硝酸铵的关系式为:NH3 ~HNO3~NH4NO3,
17 80
53.2t×88%×98% m(NH4NO3)
则:m(NH4NO3)=$\frac{80×53.2t×88%×98%}{17}$=215.83t,
答:可制得硝酸铵215.83.
点评 本题考查了化学方程式的计算,题目难度中等,正确利用反应产率为解答关键,注意掌握关系式法在化学计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
1.向溶液X中持续通入气体Y,不会产生“浑浊→澄清”现象的是( )
| A. | X:硝酸银溶液,Y:氨气 | B. | X:漂白粉溶液,Y:二氧化硫 | ||
| C. | X:氢氧化钡溶液,Y:二氧化碳 | D. | X:偏铝酸钠溶液,Y:二氧化氮 |
19.常温下下列四种溶液中,由水电离出的氢离子浓度之比(①:②:③:④)是( )
①pH=0的盐酸,②pH=1的醋酸,③0.01mol的氢氧化钠溶液,④pH=8的醋酸钠溶液.
①pH=0的盐酸,②pH=1的醋酸,③0.01mol的氢氧化钠溶液,④pH=8的醋酸钠溶液.
| A. | 1:10:102:108 | B. | 1:10:102:106 | C. | 14:13:12:8 | D. | 1:2:3:4 |
6.下列化学变化中,需要加入还原剂才能实现的是( )
| A. | C→CO2 | B. | CO→CO2 | C. | CuO→Cu | D. | H2SO4→BaSO4 |
8.常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ•mol-1)请根据下表一些键能数据完成下列问题.
(1)由表中数据规律预测C-Br键的键能范围:218 kJ•mol-1<C-Br键能<330 kJ•mol-1(填写数值和单位).
(2)已知下列热化学方程式:
O2(g)═O2+(g)+e-△H1=+1 175.7kJ/mol
PtF6(g)+e-═PtF6-(g)△H2=-771.1kJ/mol
O2+PtF6-(s)═O2+(g)+PtF6-(g)△H3=+482.2kJ/mol
则反应O2(g)+PtF6(g)═O2+PtF6-(s)△H=-77.6kJ•mol-1.
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
(2)已知下列热化学方程式:
O2(g)═O2+(g)+e-△H1=+1 175.7kJ/mol
PtF6(g)+e-═PtF6-(g)△H2=-771.1kJ/mol
O2+PtF6-(s)═O2+(g)+PtF6-(g)△H3=+482.2kJ/mol
则反应O2(g)+PtF6(g)═O2+PtF6-(s)△H=-77.6kJ•mol-1.
9.设NA表示阿伏加德罗常数的值,下列表述不正确的是( )
| A. | 标准状况下,22.4L氢气所含质子数是2NA | |
| B. | 5.4g水所含的分子数为0.3NA | |
| C. | 一个氧气分子的质量是32/NAg | |
| D. | 含1mol硫酸钾的溶液中硫酸根离子数为2NA |
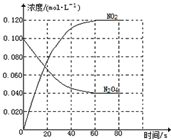 在固定容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g)随温度升高,混合气体的颜色变深.回答下列问题:
在固定容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g)随温度升高,混合气体的颜色变深.回答下列问题: