题目内容
【题目】为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置:
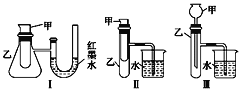
(1)上述3个装置中,不能证明“铜与浓硝 酸反应是吸热反应还是放热反应”的是(不能用手触摸和使用温度计)___________。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入 适量氢氧化钠溶液与稀盐酸,U形管中可观察到的现象是______________,说明该反应属于_____ (填“吸热”或“放热”)反应。
(3)为定量测定(2)中反应的反应热,使50 mL 0.50 mol·L-1盐酸与50 mL0.55 mol·L-1NaOH溶液在简易量热计中进行中和反应.回答下列问题:
①该实验中NaOH的浓度大于HCl的浓度的作用是_________________________。
②实验中若改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热_________ (填“相等”或“不相等”)。
(4)已知一些化学键的键能数据如表所示:
化学键 | C—H | C—F | H—F | F—F |
键能/kJ·mol-1 | 414 | 489 | 565 | 155 |
请根据键能数据估算CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式:_______________。
【答案】Ⅲ 左端液柱降低,右端液柱升高 放热 保证盐酸完全被中和,使生成水的量更精确 相等 CH4(g)+4F2(g)=CF4(g)+4HF(g) ΔH=-1 940 kJ·mol-1
【解析】
(1)装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热还是吸热;装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应放热还是吸热;装置Ⅲ只是一个铜与浓硝酸反应并将生成的气体用水吸收的装置;
(2)氢氧化钠与硫酸反应属于中和反应,中和反应都是放热反应;
(3)①在中和热的测定实验中,NaOH的浓度大于HCl的浓度能使盐酸完全被中和;
②反应放出的热量和所用酸以及碱的量的多少有关,中和热与酸碱的用量无关;
(4)反应热△H=反应物键能之和-生成物键能之和。
(1)装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热还是吸热;装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应放热还是吸热;装置Ⅲ只是一个铜与浓硝酸反应并将生成的气体用水吸收的装置,不能证明该反应是放热反应还是吸热反应,故答案为:Ⅲ;
(2)氢氧化钠与硫酸反应属于中和反应,中和反应都是放热反应,所以锥形瓶中气体受热膨胀,导致U型管左端液柱降低,右端液柱升高,故答案为:左端液柱降低,右端液柱升高;放热;
(3)①在中和热的测定实验中,NaOH的浓度大于HCl的浓度作用是使盐酸完全被中和,使生成水的量更精确,使测定结果更准确,故答案为:使盐酸完全被中和,使生成水的量更精确;
②反应放出的热量和所用酸以及碱的量的多少有关,若用60mL0.50 mol·L-1盐酸与50mL0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热是指强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等,故答案为:相等;
(4)CH4(g)和F2(g)反应的化学方程式为CH4(g)+4F2(g)=CF4(g)+4HF(g),反应热△H=反应物键能之和-生成物键能之和=414kJ/mol×4+4×155kJ/mol-(489kJ/mol×4+4×565kJ/mol)=-1940kJ/mol,则热化学方程式为CH4(g)+4F2(g)=CF4(g)+4HF(g) ΔH=-1 940 kJ·mol-1,故答案为:CH4(g)+4F2(g)=CF4(g)+4HF(g) ΔH=-1 940 kJ·mol-1。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】在生产生活中,酸碱中和及溶液酸碱性研究具有十分重要的意义。
(1)常温下,将2种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸) | c(NaOH) | 混合溶液的pH |
甲 | c(HY)=0.1mol/L | 0.1mol/L | pH=7 |
乙 | c(HZ)=0.1mol/L | 0.1mol/L | pH=9 |
①甲组实验中HY为_________(填强、弱)酸,0.1 moL/L HY溶液的pH=_____________。
②乙组实验中发生反应的离子方程式为_________________________________。
③乙组实验所得溶液中由水电离出的c(OH-)=________ mol/L。
(2)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL 0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如下图所示。

①滴定HCl溶液的曲线是___________(填“I”或“Ⅱ”);
②a=__________ mL。
③c(Na+)=c(CH3COO-)的点是_____________。
④E点对应离子浓度由大到小的顺序为_________________。
(3)将一定量某浓度的NaOH溶液,加入MgCO3悬浊液中,可以生成更难溶的Mg(OH)2。该反应的离子方程式为_____________________________。






