题目内容
【题目】氯化铜、氯化亚铜是重要的化工原料,广泛用作有机合催化剂.
已知:氯化铜容易潮解.

实验室用如图所示装置,用还原铜粉和氯气来制备氯化铜.

(1)石棉绒的作用是_________; E装置中的试剂是_____其作用____________ 。
(2)先点燃A处酒精灯,再点燃D处酒精灯的目的是______________________。
(3)若实验测得CuCl2质量分数为90.0%,则其中可能含有的杂质是_____(一种即可)。
(4)溶解时加入HCl溶液的目的主要是__________________________(结合离子方程式回答).
【答案】增大铜粉与氯气的接触面积;浓H2SO4,防止水蒸气进入D装置中排除装置中的空气石棉绒(Cu或CuCl)(一种即可).Cu2+ + 2H2O![]() Cu(OH)2+2H+,加酸抑制Cu2+的水解。
Cu(OH)2+2H+,加酸抑制Cu2+的水解。
【解析】
(1)石棉绒的作用是增大铜粉与氯气反应的接触面积;E为浓硫酸,可防止空气中的水蒸气进入D中;因此本题答案是:增大铜粉与氯气的接触面积;浓H2SO4,防止水蒸气进入D装置中。
(2)先点燃A处酒精灯,反应产生氯气,利用产生的氯气排除装置中的空气后再点燃D处酒精灯;综上所述,本题答案是:排除装置中的空气。
(3)若实验测得CuCl2质量分数为90.0%,可能含有的杂质是氯化亚铜或单质铜中的一种或两种,也可能混有石棉绒,故答案为:石棉绒(Cu或CuCl)(一种即可)。
(4)因为氯化铜是强酸弱碱盐,溶液中存在Cu2++2H2O![]() Cu(OH)2+2H+,所以溶解时加入HCl溶液,抑制氯化铜的水解;综上所述,本题答案是:Cu2+ + 2H2O
Cu(OH)2+2H+,所以溶解时加入HCl溶液,抑制氯化铜的水解;综上所述,本题答案是:Cu2+ + 2H2O![]() Cu(OH)2+2H+,加酸抑制Cu2+的水解。
Cu(OH)2+2H+,加酸抑制Cu2+的水解。

【题目】为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置:
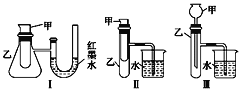
(1)上述3个装置中,不能证明“铜与浓硝 酸反应是吸热反应还是放热反应”的是(不能用手触摸和使用温度计)___________。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入 适量氢氧化钠溶液与稀盐酸,U形管中可观察到的现象是______________,说明该反应属于_____ (填“吸热”或“放热”)反应。
(3)为定量测定(2)中反应的反应热,使50 mL 0.50 mol·L-1盐酸与50 mL0.55 mol·L-1NaOH溶液在简易量热计中进行中和反应.回答下列问题:
①该实验中NaOH的浓度大于HCl的浓度的作用是_________________________。
②实验中若改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求中和热_________ (填“相等”或“不相等”)。
(4)已知一些化学键的键能数据如表所示:
化学键 | C—H | C—F | H—F | F—F |
键能/kJ·mol-1 | 414 | 489 | 565 | 155 |
请根据键能数据估算CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式:_______________。
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① | ||||||
二 | ② | ③ | ④ | ⑤ | ⑥ | ||
三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
四 | ⑾ | ⑿ | ⒀ | ||||
(1) 表中元素______的非金属性最强;元素______的金属性最强;元素______的单质室温下呈液态(填写元素符号);
(2) 表中元素⑿的原子结构示意图是___________;
(3) 表中元素⑤在周期表中的位置为____________________;
(4) 表中元素⑨和⑩最高价氧化对应水化物的酸性:__________>__________。

