题目内容
5.下列说法正确的是( )| A. | 原子晶体都是单质 | |
| B. | 分子晶体在常温下不可能为固态 | |
| C. | 非金属元素的气态氢化物越稳定,其氧化物对应的水化物酸性越强 | |
| D. | 非金属元素的气态氢化物相对分子质量越大,熔沸点不一定越高 |
分析 A.原子晶体有单质也有化合物;
B.分子晶体在常温下有固态;
C.元素的非金属性越强,其氢化物的稳定性越强,其最高价氧化物的水化物酸性越强;
D.氢化物都是分子晶体,分子晶体的熔沸点与相对分子质量成正比,含有氢键的氢化物熔沸点较高.
解答 解:A.原子晶体有单质也有化合物,如:SiO2也是原子晶体,为化合物,故A错误;
B.分子晶体在常温下有固态,如:硫、白磷等,故B错误;
C.元素的非金属性越强,其氢化物的稳定性越强,其最高价氧化物的水化物酸性越强,但其氧化物的水化物酸性不一定较强,如:稳定性HCl>H2S,但酸性:HClO<H2SO3,故C错误;
D.氢化物都是分子晶体,分子晶体的熔沸点与相对分子质量成正比,含有氢键的氢化物熔沸点较高,所以非金属元素的气态氢化物相对分子质量越大,熔沸点不一定越高,如相对分子质量HF<HCl,但HF中含有氢键导致熔沸点HF>HCl,故D正确;
故选D.
点评 本题考查晶体构成元素、晶体状态、非金属性强弱判断、氢化物的稳定性与熔沸点关系等知识点,侧重考查分析判断能力,采用举例法分析解答,注意氢键影响氢化物熔沸点,易错选项是C.

练习册系列答案
相关题目
15.下列叙述正确的是( )
| A. | 乙二醇和丙三醇含有相同的官能团,属于同系物关系 | |
| B. | 苯、甲苯、硝基苯都含有苯环,既属于芳香烃又都属于芳香族化合物 | |
| C. | 分子式为C4H8的有机物可能存在4个C-C单键 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测该有机物的结构简式为C2H5-OH |
16.下列化合物的一氯代物有三种的是( )
| A. | 2,2,3,3-四甲基丁烷 | B. | 2,3,4-三甲基戊烷 | ||
| C. | 3,4-二甲基己烷 | D. | 2,5-二甲基己烷 |
13.埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀的速度最慢的是( )
| A. | 在潮湿疏松透气的土壤中 | B. | 在干燥致密不透气的土壤中 | ||
| C. | 在含铁元素较多的酸性土壤中 | D. | 在含碳粒较多,潮湿透气的土壤中 |
20.不能用酸性KMnO4溶液鉴别的一组物质为( )
| A. | 己烷和己烯 | B. | 苯和甲苯 | C. | SO2与乙烯 | D. | 苯与苯酚溶液 |
10.把碘从碘和砂子的混合物中分离出来,可用的方法是( )
| A. | 过滤 | B. | 结晶 | C. | 蒸馏 | D. | 升华 |
14.下列离子方程式正确的是( )
| A. | 铜片加入稀盐酸中:Cu+2H+=Cu2++H2↑ | |
| B. | 盐酸滴加在石灰石上:CO32-+2H+=H2O+CO2↑ | |
| C. | 氢氧化钡溶液与稀硫酸混合:Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-+Cu2++2 OH-=BaSO4↓+Cu(OH)2↓ |
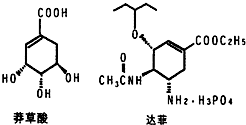 目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方.“达菲”的主要合成原料是我国盛产的莽草酸.从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒.下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构).
目前世界上已证明“达菲”是治疗禽流感和甲型H1N1流感的良方.“达菲”的主要合成原料是我国盛产的莽草酸.从八角茴香中提取的莽草酸经过多次反应和其他工艺制成“达菲”颗粒.下图是莽草酸和“达菲”有效成分的键线式结构(楔形实线、虚线表示基团的立体结构).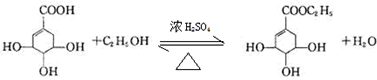 .
. .
.