��Ŀ����
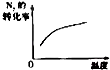
����Ŀ��T��ʱ����ij�ݻ���Ϊ2L�ܱ������г���2molN2��4molH2 �� �ڴ��������·�����Ӧ��N2��g��+3H2��g��2NH3��g����H=��92.0kJ/mol��t0ʱ�̣�����ƽ��������NH3����Ϊ2mol����t1ʱ�̿�ʼ���ı䷴Ӧ��һ����������ϵ�з�Ӧ������ʱ��仯���������ͼ��ʾ�� 
�Իش��������⣺
��1��T��ʱ��t0ʱ�̣�����ƽ���N2��ת����Ϊ�� �� �÷�Ӧ��ƽ�ⳣ��K= ��
��2��t1ʱ�̣��ı����������� ��
��3��t4ʱ�̣��ı����������� ��
��4��ƽ�ⳣ��K��t5��t6��K��t7��t8�������������=������ͬ��������ԭ���� ��
��5��T��ʱ������ƽ����������м���2molN2��2molNH3 �� ���ʱ v��v�� ��
���𰸡�
��1��50%��16
��2�������¶�
��3����Сѹǿ
��4��=��t6ʱ�̸ı������������Ӧ���Ũ��,�¶�û�иı�
��5����
���������⣺��1��ij�ݻ���Ϊ2L�ܱ������г���2molN2��4molH2���������ʼŨ�ȷֱ�Ϊ1mol/L��2mol/L����������NH3����Ϊ2mol��ƽ��ʱŨ��Ϊ1mol/L����N2��lH2ת����Ũ�ȷֱ�Ϊ��1mol/L�� ![]() =0.5mol/L��1mol/L��
=0.5mol/L��1mol/L�� ![]() =1.5mol/L��ƽ��ʱŨ�ȷֱ�Ϊ��1mol/L��0.5mol/L=0.5mol/L��2mol/L��1.5mol/L=0.5mol/L����N2��ת����Ϊ��
=1.5mol/L��ƽ��ʱŨ�ȷֱ�Ϊ��1mol/L��0.5mol/L=0.5mol/L��2mol/L��1.5mol/L=0.5mol/L����N2��ת����Ϊ�� ![]() =50%����ѧƽ�ⳣ��Ϊ��
=50%����ѧƽ�ⳣ��Ϊ�� ![]() =16���ʴ�Ϊ��50%��16����2��t1ʱ�̵�t2ʱ�̣���ѧƽ�����淴Ӧ�����ƶ��������淴Ӧ���ʾ��������жϸı������Ϊ�����¶ȣ��ʴ�Ϊ�������¶ȣ���3��t4ʱ�̣����淴Ӧ���ʶ���С������ƽ���������ƶ������Ըı������Ϊ��Сѹǿ���ʴ�Ϊ����Сѹǿ����4��t5��t6��ƽ�ⲻ�����ƶ���t6��t7�������Ӧ��������������Ӧ��Ũ�ȣ��¶�û�䣬t7��t8��ƽ�ⲻ�����ƶ����¶�Ҳû�䣬���Ի�ѧƽ�ⳣ�����䣬�ʴ�Ϊ��=��t6ʱ�̸ı������������Ӧ���Ũ�ȣ��¶�û�иı䣻��5��T��ʱ���������м���2molN2��2molNH3����N2��NH3Ũ�ȷֱ�Ϊ��0.5mol/L+
=16���ʴ�Ϊ��50%��16����2��t1ʱ�̵�t2ʱ�̣���ѧƽ�����淴Ӧ�����ƶ��������淴Ӧ���ʾ��������жϸı������Ϊ�����¶ȣ��ʴ�Ϊ�������¶ȣ���3��t4ʱ�̣����淴Ӧ���ʶ���С������ƽ���������ƶ������Ըı������Ϊ��Сѹǿ���ʴ�Ϊ����Сѹǿ����4��t5��t6��ƽ�ⲻ�����ƶ���t6��t7�������Ӧ��������������Ӧ��Ũ�ȣ��¶�û�䣬t7��t8��ƽ�ⲻ�����ƶ����¶�Ҳû�䣬���Ի�ѧƽ�ⳣ�����䣬�ʴ�Ϊ��=��t6ʱ�̸ı������������Ӧ���Ũ�ȣ��¶�û�иı䣻��5��T��ʱ���������м���2molN2��2molNH3����N2��NH3Ũ�ȷֱ�Ϊ��0.5mol/L+ ![]() =1.5mol/L��1mol/L+
=1.5mol/L��1mol/L+ ![]() =2mol/L��Ũ����Ϊ��
=2mol/L��Ũ����Ϊ�� ![]() =21.3��16����ѧƽ�����淴Ӧ�����ƶ�����v����v�����ʴ�Ϊ������
=21.3��16����ѧƽ�����淴Ӧ�����ƶ�����v����v�����ʴ�Ϊ������
��1��ת����Ϊ��ת���ķ�Ӧ��Ũ������ʼŨ�ȵİٷֱȣ���ѧƽ�ⳣ��Ϊƽ��ʱ������Ũ��ϵ�������뷴Ӧ��Ũ��ϵ�����ݳ˻��ı�ֵ����2������t1ʱ�̣����淴Ӧ���ʱ仯�жϣ���3������t4ʱ�̣����淴Ӧ���ʱ仯�жϣ���4���¶���ͬ����ѧƽ�ⳣ����ͬ����5������Ũ���̺ͻ�ѧƽ�ⳣ���Ƚϣ��жϻ�ѧƽ���ƶ�����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�����ڿ��淴ӦN2��g��+3H2��g��2NH3��g����H��0�������о�Ŀ�ĺ�ʾ��ͼ������ǣ� ��
A | B | C | D | |
�о�Ŀ�� | ѹǿ�Է�Ӧ��Ӱ�죨P2��P1�� | �¶ȶԷ�Ӧ��Ӱ�� | ƽ����ϵ����N2�Է�Ӧ��Ӱ�� | �����Է�Ӧ��Ӱ�� |
ͼʾ |
|
|
|
|
A.A
B.B
C.C
D.D