题目内容
【题目】Ⅰ.工业上制取硝酸的主要流程图如下图1:

(1)工业合成氨的原料是N2和H2。装置A的名称是 ;其中N2可从空气中分离出来,方法是先将空气 ,然后 即可得到;H2可以水和天然气为原料在催化剂作用下高温制取,其化学方程式为 。
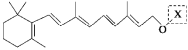
(2)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)来实现。已知1100 K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O)∶c(CO)不低于 。
CO2(g)+H2(g)来实现。已知1100 K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O)∶c(CO)不低于 。
Ⅱ.利用石灰乳来除去硝酸工业的尾气(含NO、NO2),既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如上图2。已知NO和NO2按1:1通入碱液中生成亚硝酸盐。
(1)上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是 ;滤渣可循环使用,滤渣的主要成分是 (填化学式)。
(2)该工艺需控制NO 和NO2 物质的量之比接近1:1。若n(NO):n(NO2)>1:1,则会导致 ;若n(NO):n(NO2)<1:1,则会导致 。
【答案】(15 分) Ⅰ (1) 合成塔(1分) 液化 (1分) 蒸馏或控制N2的沸点加热蒸发(1分)
CH4+H2O(g) ![]() CO+3H2 (写等号也给分 2分) (2) 5.8 (2分)
CO+3H2 (写等号也给分 2分) (2) 5.8 (2分)
Ⅱ. (1) 使尾气中的NO、NO2 被充分吸收 (2分) Ca(OH)2(2分)
(2)排放气体中NO 含量升高(2分) 产品Ca(NO2)2 中Ca(NO3)2 含量升高(2分)
【解析】
试题分析:Ⅰ.(1)工业合成氨的原料是N2和H2,合成氨的设备依次有:压缩机、合成塔、冷凝器、氨分离器、循环压缩机,装置A为合成塔,在其中为压缩的氮气和氢气反应生成氨气,反应原料N2可从空气中分离出来,方法是先将空气液化,然后蒸馏或控制N2的沸点加热蒸发,氮气先汽化,即可得到,水蒸气和甲烷反应生成一氧化碳和氢气,反应为CH4+H2O(g) ![]() CO+3H2(2)设CO的起始浓度为xmol,H2O的起始浓度为ymol,则转化的CO的最小值为0.8x,
CO+3H2(2)设CO的起始浓度为xmol,H2O的起始浓度为ymol,则转化的CO的最小值为0.8x,
CO(g)+H2O(g)CO2(g)+H2(g)
起始 x y 0 0
变化 0.8x 0.8x 0.8x 0.8x
平衡 0.2x y-0.8x 0.8x 0.8x,
根据平衡常数列式:![]() 解得:y/x=5.8,故此只要此值大于5.8,转化率就会超过80%。Ⅱ. :(1)使尾气中NO、NO2与石灰乳充分接触,NO、NO2被充分吸收;滤渣主要成分是Ca(OH)2,故答案为:使尾气中NO、NO2被充分吸收;Ca(OH)2;
解得:y/x=5.8,故此只要此值大于5.8,转化率就会超过80%。Ⅱ. :(1)使尾气中NO、NO2与石灰乳充分接触,NO、NO2被充分吸收;滤渣主要成分是Ca(OH)2,故答案为:使尾气中NO、NO2被充分吸收;Ca(OH)2;
(2)若n(NO):n(NO2)>1:1,则一氧化氮过量,排放气体中NO含量升高;若n(NO):n(NO2)<1:1,则二氧化氮过量,二氧化氮可与石灰乳反应生成Ca(NO3)2,故答案为:排放气体中NO含量升高;产品Ca(NO2)2中Ca(NO3)2含量升高。