题目内容
19.中央电视台每晚都要预报42个重点城市的空气质量,它一般将这些城市空气中SO2和可吸入颗粒的量分为8个等级.(1)空气质量预报中还预报下列物质中③的含量;
①氯气 ②氨气 ③氮氧化物 ④二氧化碳
(2)已知测定空气中SO2含量的实验仪器中装有酸性KMnO4溶液,SO2气体与酸性KMnO4溶液反应时,MnO4-被还原为Mn2+,SO2被氧化为SO42-.则该反应中SO2是还原剂(填“氧化”或“还原”),0.2mol KMnO4可以与0.5mol 的SO2反应.
(3)SO2是形成酸雨的“元凶”,SO2可以直接形成酸雨,酸雨的主要成分是H2SO4(填写化学式).
(4)若上述酸雨的pH为4,则其中c(H+)为10-4mol/L;
(5)若在实验室配置100mL pH也为4的硫酸溶液,则溶液中溶质H2SO4的物质的量为5×10-6mol.
分析 (1)空气污染指数就是将常规监测的几种空气污染物浓度简化成为单一的数值形式,并分级表示空气污染程度和空气质量状况,目前计入空气污染指数的项目主要为:可吸入颗粒物、二氧化硫、二氧化氮等;
(2)元素化合价升高做还原剂被氧化,元素化合价降低做氧化剂被还原,结合反应的离子方程式的定量关系计算0.2mol KMnO4可以需要的二氧化硫物质的量;
(3)二氧化硫和氧气在浮尘作用下反应生成三氧化硫,三氧化硫和水反应生成硫酸;
(4)依据PH=-lgc(H+)计算得到氢离子浓度;
(5)pH也为4的硫酸溶液,c(H+)=10-4mol/L,得到c(H2SO4)=5×10-5mol/L.
解答 解:(1)空气污染指数就是将常规监测的几种空气污染物浓度简化成为单一的数值形式,并分级表示空气污染程度和空气质量状况,目前计入空气污染指数的项目主要为:可吸入颗粒物、二氧化硫、二氧化氮等,空气质量预报中主要预报城市空气中SO2、可吸入颗粒的量、氮氧化物,二氧化碳是空气中的成分,氯气、氨气不是空气中常见的气体,
故答案为:③;
(2)SO2气体与酸性KMnO4溶液反应时,MnO4-被还原为Mn2+,SO2被氧化为SO42-,反应的离子方程式为:2MnO4-+5SO2+2H2O=5SO42-+4H++2Mn2+,反应中硫元素化合价升高,SO2做还原剂被氧化,Mn元素化合价降低,KMnO4做氧化剂被还原,结合反应的离子方程式的定量关系计算0.2mol KMnO4可以需要的二氧化硫物质的量0.5mol,
故答案为:还原;0.5mol;
(3)二氧化硫和氧气在浮尘作用下反应生成三氧化硫,三氧化硫和水反应生成硫酸,酸雨的主要成分是H2SO4.
故答案为:H2SO4;
(4)依据PH=-lgc(H+)计算得到氢离子浓度,若上述酸雨的pH为4,则其中c(H+)=10-4mol/L,
故答案为:10-4;
(5)pH也为4的硫酸溶液,c(H+)=10-4mol/L,得到c(H2SO4)=5×10-5mol/L,溶液中溶质H2SO4的物质的量为5×10-5mol/L,
故答案为:5×10-6mol.
点评 本题考查了二氧化硫性质的分析,酸雨形成过程,氧化还原反应分析,题目难度中等,注意掌握氧化还原反应原理和概念的理解应用,试题培养了学生的分析、理解能力及灵活应用所学知识的能力,题目难度中等.

| A. | 3mol | B. | 4mol | C. | 5mol | D. | 6mol |
| A. | 该反应能在瞬间完成,并产生大量气体 | |
| B. | 生成标准状况下2.24L气体,该反应转移电子的物质的量为0.625mol | |
| C. | 该反应中的氧化剂为KNO3 | |
| D. | 被氧化和被还原的N原子的物质的量之比为15:1 |
| A. | 42 | B. | 47 | C. | 52 | D. | 94 |
| A. | 干冰升华 | B. | 雪融化 | C. | 硝酸铵溶于水 | D. | 铁粉和硫粉反应 |
| A. | 氨气 | B. | 浓硫酸 | C. | 氢氧化钠溶液 | D. | 浓硝酸 |
| A. | CH3CH2 CH2CH3和CH3CH(CH3)2 | B. | CH2=C(CH3)2和CH3CH=CHCH3 | ||
| C. | CH3CH2OH和CH3OCH3 | D. | CH3CH2 CH2COOH 和CH3COOCH2CH3 |
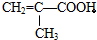 则:
则: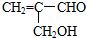 ;
;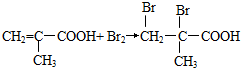 .
.