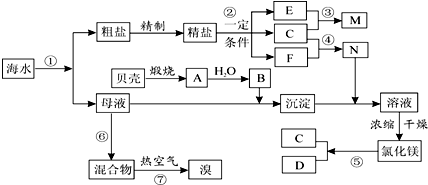
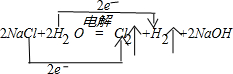
题目内容
10.汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3═K2O+5Na2O+16N2↑,则下列判断错误的是( )| A. | 该反应能在瞬间完成,并产生大量气体 | |
| B. | 生成标准状况下2.24L气体,该反应转移电子的物质的量为0.625mol | |
| C. | 该反应中的氧化剂为KNO3 | |
| D. | 被氧化和被还原的N原子的物质的量之比为15:1 |
分析 该反应中N元素化合价由-$\frac{1}{3}$价、+5价变为0价,所以叠氮化钠是还原剂、硝酸钾是氧化剂,再结合气体和转移电子之间的关系式计算.
解答 解:A.该反应中反应物没有气体、生成物有气体,且反应剧烈并产生大量气体,故A正确;
B.生成标准状况下2.24L气体,其物质的量为0.2mol,该反应转移电子的物质的量=$\frac{0.1mol}{10}$=0.16mol,故B错误;
C.该反应中N元素化合价由-$\frac{1}{3}$价、+5价变为0价,所以叠氮化钠是还原剂、硝酸钾是氧化剂,故C正确;
D.该反应中叠氮化钠中N元素被氧化、硝酸钾中N元素被还原,所以被氧化和被还原的N原子的物质的量之比=30:2=15:1,故D正确;
故选B.
点评 本题考查氧化还原反应,侧重考查氧化还原反应的计算、基本概念,明确元素化合价变化是解本题关键,注意叠氮化钠中N元素化合价,为易错点.

练习册系列答案
相关题目
20.物质的量浓度均为0.1mol•L-1的弱酸HA和NaA溶液等体积混合后,溶液中微粒浓度关系错误的是( )
| A. | c(Na+)+c(H+)=c(A-)+c(OH-) | |
| B. | c(A-)+c(HA)=2c(Na+) | |
| C. | 若混合液呈酸性,则c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) | |
| D. | 若混合液呈碱性,则c(Na+)>c(HA)>c(A-)>c(OH-)>c(H+) |
1.下列说法错误的是( )
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3mol H2O | |
| C. | 2-丁烯不存在顺反异构体 | |
| D. | 乙醇的核磁共振氢谱中有三个峰,峰面积之比是l:2:3 |
18.在一密闭容器中,反应aA(g)?bB(g)达平衡后B的浓度是1mol/L,保持温度不变,将容器体积减少一倍,当达到新的平衡时,B的浓度变为1.6mol/L,则下列正确的是( )
| A. | 平衡正反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | B的质量分数增加了 | D. | a>b |
5.下列离子方程式的书写正确的是( )
| A. | 水玻璃中通入过量二氧化碳:Na2SiO3+CO2+H2O═2Na++CO${\;}_{3}^{2-}$+H2SiO3 | |
| B. | 澄清石灰水中通入过量二氧化碳:Ca(OH)2+2CO2═Ca2++2HCO${\;}_{3}^{-}$ | |
| C. | 硅与氢氟酸的反应:Si+4H++4F-═SiF4↑+2H2↑ | |
| D. | 二氧化硅溶于烧碱溶液中:SiO2+2OH-═SiO${\;}_{3}^{2-}$+H2O |
2.下列物质中,属于烃类的是( )
| A. | CO | B. | CH3Br | C. | C2H5OH | D. | CH4 |
20.下列说法不正确的是( )
| A. | 分子式CF2Cl2、C3H8、C2H4、C2H2均只对应一种化合物 | |
| B. | 1mol C4HmO完全燃烧,最多消耗O26mol | |
| C. | 甲苯与氯气在光照下反应主要生成2-氯甲苯或4-氯甲苯 | |
| D. | 分子式为C10H14,能使酸性KMnO4溶液褪色的一元取代苯共有3种 |