题目内容
【题目】软锰矿的主要成分是二氧化锰,用软锰矿浆吸收工业废气中的二氧化硫,可以制备高纯度的硫酸锰晶体,其流程如下图所示:
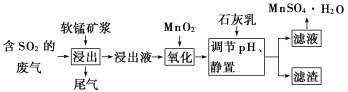
已知:
①浸出液中的金属阳离子主要是![]() ,还含有少量的
,还含有少量的![]() 、
、![]() 等,且
等,且![]() .
.
②几种离子开始沉淀和完全沉淀时的pH如表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| 7.6 | 9.7 |
| 2.7 | 3.7 |
| 3.8 | 4.7 |
| 8.3 | 9.8 |
根据上述流程,回答下列问题:
(1)写出二氧化锰与二氧化硫反应的化学方程式:_____________.
(2)用离子方程式表示加入二氧化锰的作用:________________________________.
(3)从表中数据来看,________(填“能”或“不能”)取消“加入二氧化锰”的步骤,原因是________________________.
(4)下列试剂能替代二氧化锰的是________(填序号).
A.双氧水 B.氯水 C.高锰酸钾溶液 D.次氯酸钠
(5)有同学认为可以用碳酸锰![]() 或氢氧化锰
或氢氧化锰![]() 替代石灰乳,你是否同意此观点?简述理由:______________________________________________________.
替代石灰乳,你是否同意此观点?简述理由:______________________________________________________.
(6)从含硫酸锰的滤液中提取硫酸锰晶体的操作是_____________________________.
【答案】![]()
![]() 不能
不能 ![]() 时
时![]() 才完全沉淀,而
才完全沉淀,而![]() 时
时![]() 已经开始沉淀 A 同意,
已经开始沉淀 A 同意,![]() 、
、![]() 的水解程度比
的水解程度比![]() 的大,
的大,![]() ,
,![]() ,加入的碳酸锰或氢氧化锰能与
,加入的碳酸锰或氢氧化锰能与![]() 反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去杂质 蒸发浓缩、降温结晶、过滤
反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去杂质 蒸发浓缩、降温结晶、过滤
【解析】
由浸出液中的金属阳离子主要是Mn2+,可知浸出时主要发生反应:SO2+MnO2═MnSO4,由于二氧化硫溶于水生成H2SO3,H2SO3部分电离会使浸出液pH<2,浸出液中含有少量的Fe2+、Al3+等,由离子开始沉淀及沉淀完全的pH可知,加入二氧化锰氧化过程,是将亚铁离子转化为铁离子,再加入石灰乳,调节溶液pH值,使铁离子、铝离子转化为氢氧化铁、氢氧化铝沉淀,再进行过滤,滤渣中主要有氢氧化铝、氢氧化铝,滤液为硫酸锰溶液,再通过蒸发浓缩、降温结晶,最后过滤得到硫酸锰晶体。
(1)由上述分析可知,二氧化锰与二氧化硫反应的化学方程式为SO2+MnO2═MnSO4;
(2)加入二氧化锰氧化过程,是将亚铁离子转化为铁离子,反应离子方程式为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O;
(3)由表中数据可知,pH=9.7时Fe2+才完全沉淀,而pH=8.3时Mn2+已经开始沉淀,不能取消“加入二氧化锰”的步骤,故答案为不能,pH=9.7时Fe2+才完全沉淀,而pH=8.3时Mn2+已经开始沉淀;
(4)替代二氧化锰的试剂应具有强氧化性,且不能引入杂化,氯气、酸性高锰酸钾、次氯酸均会引入杂质离子,而双氧水可以氧化亚铁离子为铁离子,同时生成水,不引入杂质离子,故选A;
(5)铁离子、铝离子水解程度比锰离子大,加热碳酸锰或氢氧化锰与氢离子反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去,同意该同学的观点,
故答案为同意,铁离子、铝离子水解程度比锰离子大,加热碳酸锰或氢氧化锰与氢离子反应,促进铁离子、铝离子水解,进而转化为沉淀,再通过过滤除去;
(6)从含硫酸锰的滤液中提取硫酸锰晶体的操作是:蒸发浓缩、降温结晶、过滤;
故答案为蒸发浓缩、降温结晶;过滤。

 名校课堂系列答案
名校课堂系列答案【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A. AB. BC. CD. D



