题目内容
【题目】研究CO、CO2的回收利用既可变废为宝,又可减少碳的排放。请回答下列问题:
(1)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料”,由CO和H2制备二甲醚的反应原理如下:
CO(g)+2H2(g)CH3OH(g) △H=-90.1kJ/mol
2CH3OH(g)CH3OCH3(g)+H2O(g) △H=-24.5kJ/mol
已知:CO(g)+H2O(g)CO2(g)+H2(g) △H=-41.0kJ/mol
则2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)的△H=________
(2)T1K时,将1mol二甲醚引入一个抽真空的150L恒容密闭容器中,发生分解反应CH3OCH3(g)CH4(g)+H2(g)+CO(g)。
在不同时间测定容器内的总压,所得数据见下表,
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
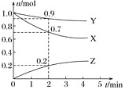
①由表中数据计算,0~6.5min内的平均反应速率)(CH3OCH3)=___
molL-1min-1(结果保留两位有效数字)反应达平衡时,二甲醚的分解率为___,该温度下平衡常数K=___。
②反应达到平衡后,若升高温度,CH3OCH3的浓度增大,则该反应为___反应(填“放热”或“吸热”)。
在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)=CH3CHO(g)
反应速率v=v正-v逆=k正p(CO)p(CH4)-k逆p(CH3HO),k正、k逆分别为k正、k逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数KP=4.5×10-5kPa-1,则CO的转化率为20%时,![]() =___。
=___。
【答案】-122.7kJ/mol 5.1×10-5mol/(Lmin) 75% 7.5×10-5 放热 0.8
【解析】
![]()
![]()
![]()
![]()
![]()
![]()
由盖斯定律![]() 的H。
的H。
(2) ①设CH3OCH3的变化量为x ,则0~6.5min内反应的三段式为
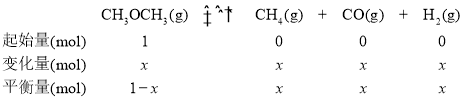
恒温恒容条件下,气体的物质的量之比等于压强之比,即![]() :
:![]() :50kPa,
:50kPa,![]() ,便可求出
,便可求出![]() min内的平均反应速率
min内的平均反应速率![]() 。
。
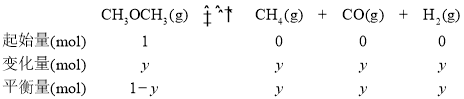
恒温恒容条件下,气体的物质的量之比等于压强之比,即![]() :
:![]() :50kPa,
:50kPa,![]() ,便可求出反应达平衡时,二甲醚的分解率;
,便可求出反应达平衡时,二甲醚的分解率;![]() ,
,![]() ,平衡常数
,平衡常数![]() ,代入数据,可求出K。
,代入数据,可求出K。
![]() 升高温度,
升高温度,![]() 的浓度增大,说明平衡逆向移动,由此可推出正反应类型。
的浓度增大,说明平衡逆向移动,由此可推出正反应类型。
当反应达到平衡时![]() ,则
,则![]() ;
;![]() K、
K、![]() 时,设起始时
时,设起始时![]() ,则
,则
反应的三段式为

所以![]() ,
,![]() ,所以
,所以![]() 、
、![]() ,
,![]() ,代入数据便可得出结果 。
,代入数据便可得出结果 。
![]()
![]()
![]()
![]()
![]()
![]()
由盖斯定律![]() 有
有![]() 的
的![]()
![]()
![]()
![]()
![]() ;
;
![]() 的
的![]()
![]() 。答案为:
。答案为:![]()
![]() ;
;
(2) ①设C3OCH3的变化量为x ,则0~6.5min内反应的三段式
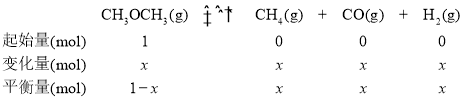
恒温恒容条件下,气体的物质的量之比等于压强之比,即![]() :
:![]() :50kPa,
:50kPa,![]() ,
,![]() min内的平均反应速率
min内的平均反应速率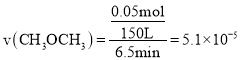
![]() ;
;
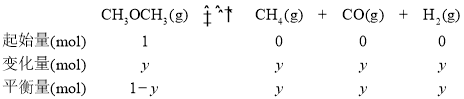
恒温恒容条件下,气体的物质的量之比等于压强之比,即![]() :
:![]() :50kPa,
:50kPa,![]() ,反应达平衡时,二甲醚的分解率
,反应达平衡时,二甲醚的分解率![]() ,
,![]() ,
,![]() ,平衡常数
,平衡常数 。答案为:
。答案为:![]()
![]() ;
;![]() ;
;![]() ;
;
![]() 升高温度,
升高温度,![]() 的浓度增大,说明平衡逆向移动,所以正向反应是放热反应。
的浓度增大,说明平衡逆向移动,所以正向反应是放热反应。
当反应达到平衡时![]() ,则
,则![]() ;
;![]() K、
K、![]() 时,设起始时
时,设起始时![]() ,则
,则
反应的三段式为

所以![]() ,
,![]() ,所以
,所以![]() 、
、![]() ,
,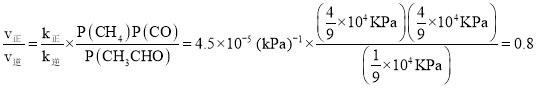 。答案为:放热;
。答案为:放热;![]() 。
。

【题目】已知:298K时,四种物质的溶度积如表所示。下列说法正确的是( )
化学式 | CH3COOAg | AgCl | Ag2CrO4 | Ag2S |
Ksp | 2.3×10-3 | 1.56×10-10 | 1.12×10-12 | 6.3×10-50 |
A.298K时,将0.001molL-1的AgNO3溶液逐滴滴入0.001molL-1的KCl和0.001molL-1的K2CrO4的混合液中,则先产生Ag2CrO4沉淀
B.298K时,向2.0×10-4molL-1的K2CrO4溶液中加入等体积的2.0×10-4molL-1的AgNO3溶液,则有Ag2CrO4沉淀生成(忽略混合时溶液体积的变化)
C.298K时,向CH3COOAg悬浊液中加入盐酸,发生反应的离子方程式为CH3COOAg+H++Cl-CH3COOH+AgCl
D.已知:![]() =0.65,298K时,四种物质的饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
=0.65,298K时,四种物质的饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)