题目内容
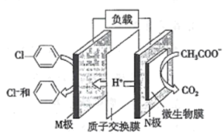
【题目】在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )
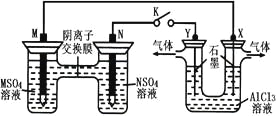
A.溶液中c(M2+)减小
B.N的电极反应式:N-2e-=N2+
C.X电极上有H2产生,发生还原反应
D.反应过程中Y电极周围生成白色胶状沉淀
【答案】C
【解析】
分析题给装置知,左侧装置为原电池,当K闭合时,SO42-从右到左通过交换膜移向M极,根据原电池原理知,M极为原电池的负极,N极为原电池的正极;右侧装置为电解池,Y为电解池的阳极,X为电解池的阴极。
A、M极为原电池的负极,电极反应式为M-2e-=M2+,溶液中c(M2+)增大,错误;
B、N极为原电池的正极,电极反应式:N2++2e-=N,错误;
C、X为电解池的阴极,电极反应式为2H++ 2e-==="=" H2↑,X电极上有H2产生,发生还原反应,正确;
D、Y为电解池的阳极,反应过程中Y电极上有氯气生成,错误;
答案选C。

【题目】研究CO、CO2的回收利用既可变废为宝,又可减少碳的排放。请回答下列问题:
(1)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料”,由CO和H2制备二甲醚的反应原理如下:
CO(g)+2H2(g)CH3OH(g) △H=-90.1kJ/mol
2CH3OH(g)CH3OCH3(g)+H2O(g) △H=-24.5kJ/mol
已知:CO(g)+H2O(g)CO2(g)+H2(g) △H=-41.0kJ/mol
则2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)的△H=________
(2)T1K时,将1mol二甲醚引入一个抽真空的150L恒容密闭容器中,发生分解反应CH3OCH3(g)CH4(g)+H2(g)+CO(g)。
在不同时间测定容器内的总压,所得数据见下表,
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由表中数据计算,0~6.5min内的平均反应速率)(CH3OCH3)=___
molL-1min-1(结果保留两位有效数字)反应达平衡时,二甲醚的分解率为___,该温度下平衡常数K=___。
②反应达到平衡后,若升高温度,CH3OCH3的浓度增大,则该反应为___反应(填“放热”或“吸热”)。
在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)=CH3CHO(g)
反应速率v=v正-v逆=k正p(CO)p(CH4)-k逆p(CH3HO),k正、k逆分别为k正、k逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数KP=4.5×10-5kPa-1,则CO的转化率为20%时,![]() =___。
=___。