��Ŀ����
����Ŀ��ʵ�����Ʊ�1��2����������ķ�Ӧԭ�����£�
CH3CH2OH  CH2=CH2
CH2=CH2
CH2=CH2+Br2��BrCH2CH2Br
���ܴ��ڵ���Ҫ����Ӧ�У��Ҵ���Ũ����Ĵ�������140����ˮ�������ѣ�
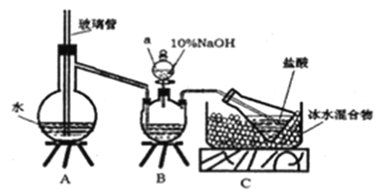
������������������Ҵ��Ʊ�1��2�����������װ����ͼ��ʾ��
�й������б����£�
�Ҵ� | 1��2���������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/gcm��3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | -130 | 9 | ��116 |
�ش��������⣺
��1���ڴ��Ƹ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�������ҪĿ������������ȷѡ��ǰ����ĸ��
a��������Ӧ b���ӿ췴Ӧ�ٶ� c����ֹ�Ҵ��ӷ� d�����ٸ�������������
��2����װ��C��Ӧ���� �� ��Ŀ�������շ�Ӧ�п������ɵ��������壺������ȷѡ��ǰ����ĸ��
a��ˮ b��Ũ���� c������������Һ d������̼��������Һ
��3�������������������������ѣ������ķ�����ȥ��
��4����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ���DZ���������ӷ������ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ���� ��
���𰸡�
��1��d
��2��c
��3������
��4����Ʒ1,2������������۵㣨���̵㣩��,������ȴ�����̶���������
���������⣺ʵ�����Ʊ�1��2���������飺������ƿA�з�����Ӧ���Ҵ���Ũ����������·�����������ˮ��ȡ��ϩ���Ҵ���������ȥ��Ӧ����Ӧ����ʽΪ��CH3CH2OH ![]() CH2=CH2��+H2O�����D�е����ܷ��������¹ʣ�A�в�������ϩ����ᵼ��װ��B��ѹǿ��������Һ�������������װ��B�г������ܿ��ж�װ���Ƿ������װ��B�����ã�Ũ���������ˮ�ԡ���ˮ�Ժ�ǿ�����ԣ��������Ҵ���CH3CH2OH+4H2SO4��Ũ��
CH2=CH2��+H2O�����D�е����ܷ��������¹ʣ�A�в�������ϩ����ᵼ��װ��B��ѹǿ��������Һ�������������װ��B�г������ܿ��ж�װ���Ƿ������װ��B�����ã�Ũ���������ˮ�ԡ���ˮ�Ժ�ǿ�����ԣ��������Ҵ���CH3CH2OH+4H2SO4��Ũ�� ![]() 4SO2��+CO2��+7H2O+C���������ɵ���������Ϊ������������̼��װ��C�з�����������Һ��������ӦSO2+2NaOH=Na2SO3+H2O��CO2+2NaOH�TNa2CO3+H2O����ȥ�������壬��ϩ���в����ͼ�C=C˫������±�ص��ʷ����ӳɷ�Ӧ��D����ϩ����ӳ�����1��2���������飬��ӦΪ��CH2=CH2+Br��Br��CH2Br��CH2Br���Ƶ�1��2���������飮
4SO2��+CO2��+7H2O+C���������ɵ���������Ϊ������������̼��װ��C�з�����������Һ��������ӦSO2+2NaOH=Na2SO3+H2O��CO2+2NaOH�TNa2CO3+H2O����ȥ�������壬��ϩ���в����ͼ�C=C˫������±�ص��ʷ����ӳɷ�Ӧ��D����ϩ����ӳ�����1��2���������飬��ӦΪ��CH2=CH2+Br��Br��CH2Br��CH2Br���Ƶ�1��2���������飮
��1���Ҵ���Ũ����140��������£�������������ˮ�������ѣ�2CH3CH2OH ![]() CH3CH2OCH2CH3+H2O��Ҫ������Ѹ�ٵذѷ�Ӧ�¶����170�����ң�������ҪĿ���ǣ����ٸ������������ɣ�
CH3CH2OCH2CH3+H2O��Ҫ������Ѹ�ٵذѷ�Ӧ�¶����170�����ң�������ҪĿ���ǣ����ٸ������������ɣ�
���Դ��ǣ�d��
��2��Ũ�������ǿ�����ԣ����Ҵ������ɶ�����̼����������ԭ�ɶ�������CH3CH2OH+4H2SO4��Ũ�� ![]() 4SO2��+CO2��+7H2O+C��������̼�����������ܺ�����������Һ��Ӧ��������װ��C��Ӧ��������������Һ�����շ�Ӧ�п������ɵ��������壬
4SO2��+CO2��+7H2O+C��������̼�����������ܺ�����������Һ��Ӧ��������װ��C��Ӧ��������������Һ�����շ�Ӧ�п������ɵ��������壬
���Դ��ǣ�c��
��3��1��2���������������ѵķе㲻ͬ�����߾�Ϊ�л�����ܣ�������ķ��������Ƿ��룬
���Դ��ǣ�����
��4�����ڳ����£��ӷ�����ϩ���巴Ӧʱ���ȣ�����ӷ�����ȴ�ɱ�����Ĵ����ӷ�����1��2��������������̵�9��ϵͣ����ܹ�����ȴ��������ȴ�����̶��������ܣ�
���Դ��ǣ���Ʒ1��2������������۵㣨���̵㣩�ͣ�������ȴ�����̶��������ܣ�

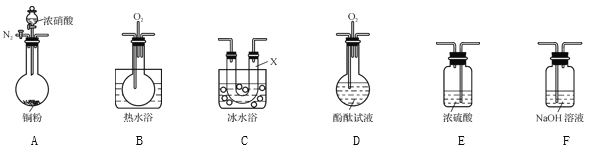
����Ŀ��������װ���Ʊ�������������,��̽����ز������ʡ�
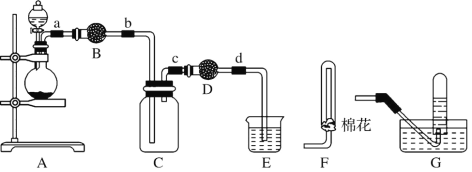
(1) װ��A�еķ�Һ©��ʢװ��Һ����____,��ƿ��Ԥ�ȼ������ͭм,���ļ۸��ͭ�ļ۸��,�˴���ͭ��������ԭ����______________��
(2) �����B��D��ʢװ�ĸ����������____(�Ũ���ᡱ������ˮ�Ȼ��ơ��������������ס���ʯ�ҡ�),�����D�и������������______________��
(3) װ��E������������β��,���չ����з�����Ӧ�Ļ�ѧ����ʽ����,�뽫�䲹��������
NaOH+ NO2![]() ������+ NaNO2+ H2O ______
������+ NaNO2+ H2O ______
(4) ij��ѧ��ȤС����Ϊͭ������Ũ���ᷴӦ�����������к�NO,ѡ�����б�Ҫ��װ��(N2��O2�����������ɿ���)�����֤ʵ�顣
��֪:
i. NO+NO2+2OH-![]() 2NO2-+H2O
2NO2-+H2O
ii����Һ���¶�����:
���� | NO2 | NO |
Һ���¶� | 21 �� | -152 �� |
������������˳��(�������������,���������ĸ)Ϊ________��
��ʵ��ʱ�ȼ��װ�������Ժ�,�ټ����Լ�,�ڷ�Ӧǰ�IJ�����_______��
��ȷ�������к�NO��������__________;װ��C��������____��
��NH3����ԭ��������(SCR)������ĿǰӦ����㷺�������е��������ѳ�������������NO��NO2�Ļ����6 L,����ͬ��ͬѹ��7 L NH3ǡ��ʹ����ȫת��ΪN2,��ԭ���������NO��NO2�����ʵ���֮��Ϊ____��