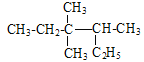题目内容
【题目】双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2为还原产物),其电解的化学方程式为:3H2O+3O2![]() O3+3H2O2。下列有关说法正确的是
O3+3H2O2。下列有关说法正确的是
A. 电解池的阳极生成双氧水,阴极生成臭氧
B. 电解池中H+移向阴极
C. 产生臭氧的电极反应式为3H2O+6e-=O3+6H+
D. 产生双氧水的电极反应式为2H2O-2e- =H2O2+2H+
【答案】B
【解析】题中“H2O2为还原产物”,可说明H2O2在电解池阴极生成,电极反应式为3O2+6e-+6H+=3H2O2,则O3为阳极上的氧化产物,电极反应为3H2O-6e-=O3+6H+。A.题中“H2O2都为还原产物”,可说明H2O2在电解池阴极生成,O3为阳极产物,故A错误;B.电解时,阳离子向阴极移动,故B正确;C.H2O2都为还原产物,则O3为氧化产物,电极反应为3H2O-6e-=O3+6H+,故C错误;D.H2O2为还原产物,产生双氧水的电极反应式为3O2+6e-+6H+=3H2O2,故D错误;故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目