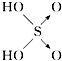题目内容
【题目】根据如图回答,下列说法不正确的是( ) 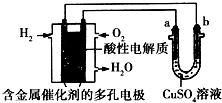
A.此装置用于铁表面镀铜时,a为铁
B.此装置用于电镀铜时,硫酸铜溶液的浓度不变
C.燃料电池中正极反应为 ![]() O2+2e﹣+2H+═H2O
O2+2e﹣+2H+═H2O
D.若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
【答案】A
【解析】解:氢氧燃料电池中,通入氢气的电极一定是负极,通入氧气的电极一定是正极,故b极为阴极,a极为阳极. A、铁表面镀铜时,金属铜必须作阳极,金属铁作阴极,所以a为金属铜,故A错误;
B、此装置用于电镀铜时,金属铜必须作阳极,电解前后硫酸铜溶液的浓度不变,故B正确;
C、氢氧燃料电池中,通入氧气的电极一定是正极,在酸性环境下,氧气放电的反应为: ![]() O2+2H++2e﹣=H2O,故C正确;
O2+2H++2e﹣=H2O,故C正确;
D、电解精炼铜时,粗铜作阳极,精铜作阴极,1mol水生成,转移2mol电子,可得到64g铜,故D正确.
故选A.

练习册系列答案
相关题目
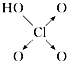
【题目】判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.含氧酸酸性强弱与非羟基氧原子数的关系如表所示:
含氧酸 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
结构式 | Cl﹣OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
已知:亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性.由此可推出:
①H3PO3的结构式为 , H3PO3与过量的NaOH溶液反应的化学方程式为;
②H3AsO3的结构式为 , 在H3AsO3中加入浓盐酸,反应的化学方程式为 .