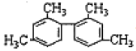
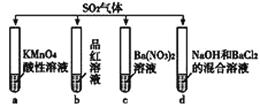
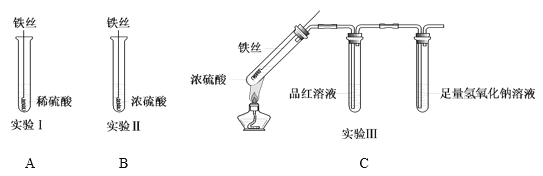
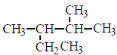题目内容
【题目】NA为阿伏加德罗常数的值,下列叙述错误的是( )
A. 1.8gH2O中含有的质子数为NA
B. 22.4L氯气与足量镁粉充分反应,转移的电子数为2NA
C. 46gNO2和N2O4混合气体中含有原子总数为3NA
D. 23gNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
【答案】B
【解析】
A.1.8g水的物质的量为![]() =0.1mol,含有1mol质子,含有的质子数为NA,故A正确;
=0.1mol,含有1mol质子,含有的质子数为NA,故A正确;
B.未告知气体所处的温度和压强,无法计算22.4L氯气的物质的量,也无法确定转移的电子数,故B错误;
C.46gNO2和N2O4的含有NO2原子团的物质的量为![]() =1mol,含有原子的总物质的量为3mol,含有原子总数为3NA,故C正确;
=1mol,含有原子的总物质的量为3mol,含有原子总数为3NA,故C正确;
D.钠与氧气反应无论生成氧化钠还是过氧化钠,1个钠原子都失去1个电子生成1个钠离子,则23gNa与足量O2反应,生成Na2O和Na2O2的混合物,生成1mol钠离子,失去NA个电子,故D正确;
故选B。

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】氮和磷元素的单质和化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列问题:
(1)科学家合成了一种阳离子为“N5n+”,其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,其电子式为___,其中的阴离子的空间构型为___。
(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子的形式存在。N4H44+根系易吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。1个N4H44+中含有___个σ键。
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因___。
(4)P4S3可用于制造火柴,其分子结构如图1所示。
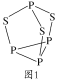
①P4S3分子中硫原子的杂化轨道类型为___。
②每个P4S3分子中含孤电子对的数目为___。
(5)某种磁性氮化铁的晶胞结构如图2所示,该化合物的化学式为___。若晶胞底边长为anm,高为cnm,则这种磁性氮化铁的晶体密度为__g·cm3(用含a、c和NA的式子表示)

(6)高温超导材料,是具有高临界转变温度(Te)能在液氮温度条件下工作的超导材料。高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为[Ar]__;化合物中,稀土元素最常见的化合价是+3,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是___(填元素符号)。
几种稀土元素的电离能(单位:kJ·mol1)
元素 | I1 | I2 | I3 | I4 |
Sc(钪) | 633 | 1235 | 2389 | 7019 |
Y(铱) | 616 | 1181 | 1980 | 5963 |
La(镧) | 538 | 1067 | 1850 | 4819 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
【题目】某化学反应中,设反应物的总能量为E1,生成物的总能量为E2,
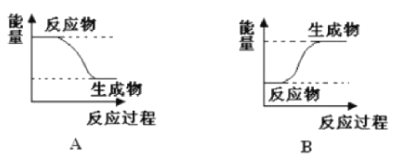
I.若E1>E2,则该反应为_____(填“放热”或“吸热”)反应。该反应可用图____(填“A”或“B”)表示。
II.若E1<E2,则该反应为______(填“放热”或“吸热”)反应。该反应可用图_____(填“A”或“B”)表示
III.下表中的数据是破坏1mol物质中的化学键所消耗的最小能量:
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是(_____)
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中最稳定的是(_____)
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?_______。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是_____(填写化学式)。