题目内容
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
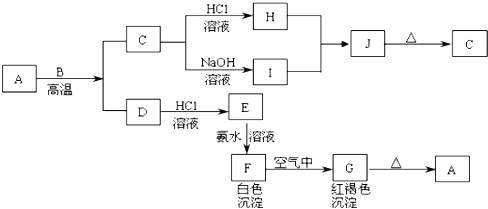
请回答下列问题
(1)写出下列物质的化学式A______,E_______,J________,G_______。
(2)F在空气中转化为G的化学方程式:______。
(3)C转化为I的离子方程式:______。
(4)H和I生成J的离子方程式:______。
(5)D在高温下和水蒸气反应的化学方程式:______。
(6)如何检验E中大量存在的阳离子?___________。
【答案】Fe2O3 FeCl2 Al(OH)3 Fe(OH)3 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Al2O3+2OH-=2AlO2-+H2O Al3++3AlO2-+6H20=4Al(OH)3↓ 3Fe+4H2O(g)![]() Fe3O4+4H2 加入KSCN溶液无现象,再加入新制氯水溶液显血红色则证明有Fe2+
Fe3O4+4H2 加入KSCN溶液无现象,再加入新制氯水溶液显血红色则证明有Fe2+
【解析】
解题的突破口:A是一种红棕色金属氧化物,所以是三氧化二铁,根据白色沉淀在空气中转化为红褐色沉淀可知一定是氢氧化亚铁和氢氧化铁之间的转换,根据物质的性质来推断其他物质然后进行回答。
根据题目信息,A一定是三氧化二铁,F是氢氧化亚铁,G是氢氧化铁,氢氧化铁受热易分解为三氧化二铁,所以E是氯化亚铁溶液,D是金属单质铁,A和B的反应为铝热反应,又因为J是一种难溶于水的白色化合物并易受热分解,推知是氢氧化铝,所以B是金属铝,C是氧化铝,J是氢氧化铝,H是氯化铝,I是偏铝酸钠。则
(1)根据以上分析可知A、E、J、G的化学式分别是Fe2O3、FeCl2、Al(OH)3、Fe(OH)3;
(2)氢氧化亚铁容易被空气中的氧气氧化为氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)氧化铝是两性氧化物,能和强碱反应,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O。
(4)铝离子和偏铝酸根之间双水解而不共存生成氢氧化铝,反应的离子方程式为Al3++3AlO2-+6H20=4Al(OH)3↓。
(5)铁和水蒸气在高温下发生的置换反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。
(6)实验室检验亚铁离子的方法是加入KSCN溶液无现象,再加入新制氯水溶液显血红色则证明有Fe2+。

【题目】(2018·四川省成都市第三次诊断性检测)已知H2A为二元弱酸,室温下向100.0mL0.1mol/LH2A溶液中加入不同质量的NaOH固体,pH变化如下表(不考虑溶液体积变化)。下列分析正确是
m(NaOH)/g | 0 | 0.4 | 0.8 | 1.2 |
pH | 3.8 | 8.3 | 12.0 | 13.2 |
A. H2A第一步电离K1的数量级为10-8
B. 上述过程中水的电离程度一直增大
C. m(NaOH)=0.6g时,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. 若溶液中加NaOH至![]() 时,c(OH-)>100c(H+)
时,c(OH-)>100c(H+)
