题目内容
【题目】X、Y、Z、Q、R均为短周期元素(原子序数Y<X<R<Q<Z)。25℃时,其最高价氧化物的水化物溶液(浓度均为0.001mol/L)的pH和原子半径的关系如图所示。下列说法中正确的是( )
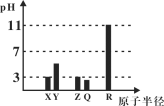
A.X和R的简单离子半径:X < R
B.Z、Q的气态氢化物的稳定性:Z > Q
C.Z的最高价氧化物对应水化物的化学式为HZO3
D.上述五种元素中有两种元素是金属元素
【答案】B
【解析】
这几种元素都是短周期元素,XYZQ元素最高价氧化物的水合物溶液pH都小于7,说明其最高价氧化物的水合物都是酸,则这几种元素都是非金属元素,0.001mol/L的X、Z的最高价氧化物的水合物pH=3,为一元强酸,X的原子半径最小,该强酸是硝酸,则X为N元素,Z为S元素;Y的原子序数小于X,且为弱酸,应该是C元素;Z的原子半径大于X且为一元强酸,为Cl元素;R的氧化物的水合物呈碱性,且0.001mol/L的R最高价氧化物的水合物pH=11,则为一元强碱,且原子半径最大,则为Na元素;通过以上分析知,XYZQR分别是N、C、Cl、S、Na元素。
A.X和R分别是N、Na元素,氮离子和钠离子电子层结构相同,电子层结构相同的离子,离子半径随着原子序数增大而减小,则离子半径:X>R,故A错误;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S,则氢化物的稳定性:Z>Q,故B正确;
C.D为Cl元素,其最高价氧化物的水合物是HClO4,故C错误;
D.这几种元素中只有Na是金属元素,故D错误;
故选:B。

【题目】我国在南海北部神弧海域进行的可燃冰试采成功,这标志着我国成为全球第一个实现了在海域可燃冰试开采中获得连续稳定产气的国家。可燃冰主要成分是甲烷,可以用作燃料和制氢原料。甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整两个过程。发生的主要反应如下:
化学方程式 | 焓变ΔH/(kJ·mol-1) | 活化能Ea/(kJ·mol-1) | |
甲烷氧化 | CH4(g)+2O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | Ⅰ.CH4(g)+H2O(g) | +206.2 | 240.1 |
Ⅱ.CH4(g)+2H2O(g) | +165 | 243.9 |
下列说法不正确的是
A.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
B.反应Ⅱ逆反应活化能Ea=78.9kJ·mol-1
C.初始阶段:甲烷氧化的速率大于甲烷蒸气重整的速率
D.甲烷自热重整方法的突出优点是能量循环利用
【题目】常温常压下,在四支相同的试管中,分别装入等物质的量混合的两种气体。混合气体具体组成如下:
试管编号 | 1 | 2 | 3 | 4 |
混合气体组成 | Cl2、SO2 | NO2、O2 | NO、O2 | NH3、N2 |
将四支试管迅速同时倒立于水槽中,至液面稳定后,水面上升高度由大到小正确的是( )
A.1>2>3>4B.3>1>4>2
C.4>2>3>1D.1>3>2>4
【题目】![]() 使
使![]() 和
和![]() 通过灼热的炭层,生成HCl和
通过灼热的炭层,生成HCl和![]() ,当有
,当有![]() 参与反应时释放出145kJ热量,写出该反应的热化学方程式________________.
参与反应时释放出145kJ热量,写出该反应的热化学方程式________________.
![]() 火箭和导弹表面的薄层是耐高温物质
火箭和导弹表面的薄层是耐高温物质![]() 将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料
将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料![]() ,则反应过程中,每转移1mol电子放出的热量为____________.
,则反应过程中,每转移1mol电子放出的热量为____________.
![]() 甲胺
甲胺![]() 是合成太阳能敏化剂的原料。工业合成甲胺原理:
是合成太阳能敏化剂的原料。工业合成甲胺原理:![]()
![]()
![]() 。
。
![]() 已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 |
|
|
|
|
|
键能 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的![]() ______________。
______________。
若![]() 的活化能为
的活化能为![]() ,由此计算
,由此计算![]()
![]() 的活化能
的活化能![]() ______。
______。
![]() 用
用![]() 将HCl转化为
将HCl转化为![]() ,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,
,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,
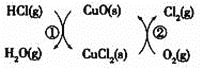
其中,反应![]() 为:
为:![]() 反应
反应![]() 生成
生成![]() 的反应热为
的反应热为![]() ,则总反应的热化学方程式为_____________,
,则总反应的热化学方程式为_____________,![]() 反应热用
反应热用![]() 和
和![]() 表示
表示![]() .
.