题目内容
【题目】![]() 使
使![]() 和
和![]() 通过灼热的炭层,生成HCl和
通过灼热的炭层,生成HCl和![]() ,当有
,当有![]() 参与反应时释放出145kJ热量,写出该反应的热化学方程式________________.
参与反应时释放出145kJ热量,写出该反应的热化学方程式________________.
![]() 火箭和导弹表面的薄层是耐高温物质
火箭和导弹表面的薄层是耐高温物质![]() 将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料
将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料![]() ,则反应过程中,每转移1mol电子放出的热量为____________.
,则反应过程中,每转移1mol电子放出的热量为____________.
![]() 甲胺
甲胺![]() 是合成太阳能敏化剂的原料。工业合成甲胺原理:
是合成太阳能敏化剂的原料。工业合成甲胺原理:![]()
![]()
![]() 。
。
![]() 已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 |
|
|
|
|
|
键能 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的![]() ______________。
______________。
若![]() 的活化能为
的活化能为![]() ,由此计算
,由此计算![]()
![]() 的活化能
的活化能![]() ______。
______。
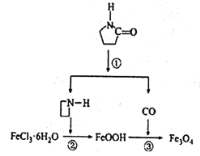
![]() 用
用![]() 将HCl转化为
将HCl转化为![]() ,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,
,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,
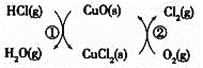
其中,反应![]() 为:
为:![]() 反应
反应![]() 生成
生成![]() 的反应热为
的反应热为![]() ,则总反应的热化学方程式为_____________,
,则总反应的热化学方程式为_____________,![]() 反应热用
反应热用![]() 和
和![]() 表示
表示![]() .
.
【答案】![]()
![]()
![]()
![]()
![]()
【解析】
根据题干信息及热化学方程式的含义书写相关反应的热化学方程式;根据热化学方程式及氧化还原反应中化合价的变化通过电子转移数目计算反应热;根据反应过程中化学键的变化,用已知的键能计算反应热及活化能;根据图示物质间的转化关系结合热化学方程式运用盖斯定律计算反应热,书写热化学方程式。
![]() 参与反应时释放出145KJ热量,则反应
参与反应时释放出145KJ热量,则反应![]() 会放出290KJ的能量,即
会放出290KJ的能量,即![]() ;
;
故答案为:![]() ;
;
![]() ,转移12mol电子放热1176KJ,则反应过程中,每转移1mol电子放热98kJ;
,转移12mol电子放热1176KJ,则反应过程中,每转移1mol电子放热98kJ;
故答案为:98kJ;
![]() ,反应热
,反应热![]() 正反应的活化能
正反应的活化能![]() 逆反应的活化能
逆反应的活化能![]() ,即
,即![]()
![]()
![]() ;
;
故答案为:![]()
![]() ;312
;312![]() ;
;
![]() 由图示可知,整个过程为:
由图示可知,整个过程为:![]() ,反应
,反应![]() 为:
为:![]() ,
,
反应![]() 生成
生成![]() 的反应热为
的反应热为![]() ,则反应热化学方程式为:
,则反应热化学方程式为:![]() ,
,
根据盖斯定律![]() 可得总反应的热化学方程式:
可得总反应的热化学方程式:![]() ,所以
,所以![]() ,故答案为:
,故答案为:![]() 。
。