题目内容
【题目】吊白块( NaHSO2·HCHO·2H2O,M=154.0g/mol)在工业中有广泛应用;吊白块在酸性环境下、100℃即发生分解释放出HCHO。实验室制备吊白块的方案如下:
NaHSO3的制备:
如图,在广口瓶中加入一定量Na2SO3和水,振荡溶解,缓慢通入SO2,至广口瓶中溶液pH约为4,制得NaHSO3溶液。
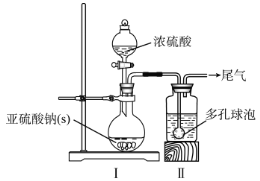
(1)装置Ⅰ中产生气体的化学反应方程式为__;Ⅱ中多孔球泡的作用是__。
(2)实验室检测NaHSO3晶体在空气中是否发生氧化变质的实验方案是__。
吊白块的制备:
如图,向仪器A中加入上述NaHSO3溶液、稍过量的锌粉和一定量甲醛,在80~90℃C下,反应约3h,冷却过滤。

(3)仪器A的名称为___;用恒压漏斗代替普通滴液漏斗滴加甲醛的优点是__。
(4)将仪器A中的反应温度恒定在80~90℃的目的是__。
吊白块纯度的测定:
将0.5000g吊白块样品置于蒸馏烧瓶中,加入10%磷酸10mL,立即通入100℃水蒸气;吊白块分解并释放出甲醛,用含36.00mL0.1000mol·L-1酸性KMnO4吸收甲醛(不考虑SO2影响,4MnO4-+5HCHO+12H+=4Mn2++5CO2↑+11H2O),再用0.1000mol·L-1的草酸标准溶液滴定酸性KMnO4,再重复实验2次,平均消耗草酸溶液的体积为30.00mL。
(5)滴定终点的判断方法是__;吊白块样品的纯度为__%(保留四位有效数字);若KMnO4标准溶液久置释放出O2而变质,会导致测量结果__(填“偏高”、“偏低”或“无影响”)
【答案】Na2SO3 + H2SO4 = Na2SO4 + SO2↑+ H2O 增大气体与溶液的接触面积,加快气体的吸收速率 取少量NaHSO3晶体于试管中,加少量水溶解,滴加过量盐酸,再滴加氯化钡溶液,看是否有白色沉淀生成,若有,说明NaHSO3被氧化 三颈烧瓶 恒压滴液漏斗可以保持内外压强一致,液体顺利流下,同时避免HCHO挥发 温度过低反应较慢,温度过高会导致吊白块分解 当滴入最后一滴草酸溶液,锥形瓶内溶液颜色由紫红色变为无色,且半分钟内部变为原来的颜色 92.40% 偏高
【解析】
⑴装置Ⅰ中产生气体的化学反应方程式为Na2SO3 + H2SO4 = Na2SO4 + SO2↑+ H2O;Ⅱ中多孔球泡的作用是可以增大气体与液体的接触面积,加快气体的吸收速率。
⑵实验室检测NaHSO3晶体在空气中是否发生氧化变质的实验方案是其实就是硫酸根离子的检验,首先排除亚硫酸氢根离子干扰,所以取少量NaHSO3晶体于试管中,加少量水溶解,滴加过量盐酸,再滴加氯化钡溶液,看是否有白色沉淀生成,若有,说明NaHSO3被氧化。
⑶仪器A的名称为三颈烧瓶;用恒压漏斗代替普通滴液漏斗滴加甲醛的优点是恒压滴液漏斗可以保持内外压强一致,液体顺利流下,同时避免HCHO挥发。
⑷根据信息吊白块在酸性环境下、100℃即发生分解释放出HCHO,因此将仪器A中的反应温度恒定在80~90℃的目的是温度过低反应较慢,温度过高会导致吊白块分解。
⑸滴定终点的判断方法是当滴入最后一滴草酸溶液,锥形瓶内溶液颜色由紫红色变为无色,且半分钟内部变为原来的颜色;
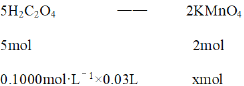
5mol:0.1000mol·L-1×0.03L = 2mol :xmol
解得x = 1.2×10-3mol
36.00mL0.1000mol·L-1酸性KMnO4的物质的量为36.00×10-3L×0.1000mol·L-1 = 3.6×10-3mol,则甲醛消耗得高锰酸钾的物质的量为3.6×10-3mol - 1.2×10-3mol=2.4×10-3mol,再根据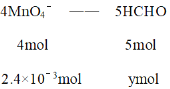
4mol:2.4×10-3mol = 5mol:ymol
解得y = 3×10-3mol
![]() ,若KMnO4标准溶液久置释放出O2而变质,消耗草酸量减少,则计算出高锰酸钾与甲醛反应得多,则计算出吊白块测量结果偏高。
,若KMnO4标准溶液久置释放出O2而变质,消耗草酸量减少,则计算出高锰酸钾与甲醛反应得多,则计算出吊白块测量结果偏高。
⑴装置Ⅰ中产生气体的化学反应方程式为Na2SO3 + H2SO4 = Na2SO4 + SO2↑+ H2O;Ⅱ中多孔球泡的作用是可以增大气体与液体的接触面积,加快气体的吸收速率,故答案为:Na2SO3 + H2SO4 = Na2SO4 + SO2↑+ H2O;增大气体与溶液的接触面积,加快气体的吸收速率。
⑵实验室检测NaHSO3晶体在空气中是否发生氧化变质的实验方案是其实就是硫酸根离子的检验,首先排除亚硫酸氢根离子干扰,所以取少量NaHSO3晶体于试管中,加少量水溶解,滴加过量盐酸,再滴加氯化钡溶液,看是否有白色沉淀生成,若有,说明NaHSO3被氧化,故答案为:取少量NaHSO3晶体于试管中,加少量水溶解,滴加过量盐酸,再滴加氯化钡溶液,看是否有白色沉淀生成,若有,说明NaHSO3被氧化。
⑶仪器A的名称为三颈烧瓶;用恒压漏斗代替普通滴液漏斗滴加甲醛的优点是恒压滴液漏斗可以保持内外压强一致,液体顺利流下,同时避免HCHO挥发,故答案为:恒压滴液漏斗可以保持内外压强一致,液体顺利流下,同时避免HCHO挥发。
⑷根据信息吊白块在酸性环境下、100℃即发生分解释放出HCHO,因此将仪器A中的反应温度恒定在80~90℃的目的是温度过低反应较慢,温度过高会导致吊白块分解,故答案为:温度过低反应较慢,温度过高会导致吊白块分解。
⑸滴定终点的判断方法是当滴入最后一滴草酸溶液,锥形瓶内溶液颜色由紫红色变为无色,且半分钟内部变为原来的颜色;
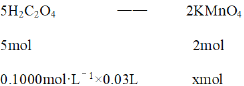
5mol:0.1000mol·L-1×0.03L = 2mol :xmol
解得x = 1.2×10-3mol
36.00mL0.1000mol·L-1酸性KMnO4的物质的量为36.00×10-3L×0.1000mol·L-1 = 3.6×10-3mol,则甲醛消耗得高锰酸钾的物质的量为3.6×10-3mol - 1.2×10-3mol=2.4×10-3mol,再根据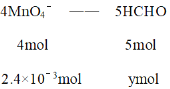
4mol:2.4×10-3mol = 5mol:ymol
解得y = 3×10-3mol
![]() ,若KMnO4标准溶液久置释放出O2而变质,消耗草酸量减少,则计算出高锰酸钾与甲醛反应得多,则计算出吊白块测量结果偏高,故答案为:当滴入最后一滴草酸溶液,锥形瓶内溶液颜色由紫红色变为无色,且半分钟内部变为原来的颜色;92.40%;偏高。
,若KMnO4标准溶液久置释放出O2而变质,消耗草酸量减少,则计算出高锰酸钾与甲醛反应得多,则计算出吊白块测量结果偏高,故答案为:当滴入最后一滴草酸溶液,锥形瓶内溶液颜色由紫红色变为无色,且半分钟内部变为原来的颜色;92.40%;偏高。

 阅读快车系列答案
阅读快车系列答案