题目内容
【题目】某校课外小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验.
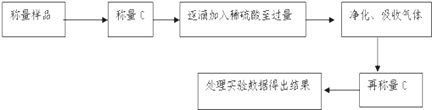
方案Ⅰ.甲组同学用质量法,按如下图所示的实验流程进行实验:

(1)实验时,蒸发结晶操作中,除了酒精灯外,还要用到的仪器是_______
(2)有同学认为“加入适量盐酸”不好操控,应改为“过量盐酸”,便于操作且不影响测定的准确性,你认为对或错_______,为什么___________________
(3)若实验中测得样品质量为46.4g,固体质量为40.95g,则碳酸钠的质量分数为_______.(保留3位有效数字)
(4)蒸发结晶过程中若有固体飞溅,测得碳酸钠的质量分数____________(填偏大 偏小 无影响).
方案Ⅱ:乙组同学的主要实验流程图如下:
按如下图所示装置进行实验:
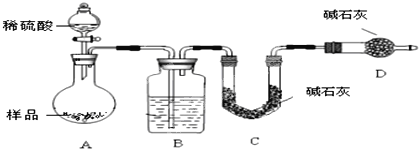
(5)在C中装碱石灰来吸收净化后的气体.D装置的作用是_____________________.
(6)有的同学认为为了减少实验误差,在反应前后都通入N2,反应后通入N2的目的是______________________________.
方案Ⅲ:气体分析法
(7)把一定量样品与足量稀硫酸反应后,用如图装置测量产生CO2气体的体积,B溶液最好采用_________(以下选项中选择)使测量误差较小.
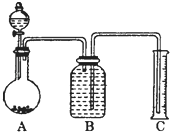
A.饱和碳酸钠溶液 | B.饱和碳酸氢钠溶液 |
C.饱和氢氧化钠溶液 | D.饱和硫酸铜溶液 |
【答案】)蒸发皿、玻璃棒 对 因盐酸易挥发,过量的盐酸在加热过程中挥发不残留,不影响结果 45.7% 偏小 吸收空气中的水蒸气和二氧化碳,以确保前一个干燥管中质量增加量的准确性 将B、C装置中残留CO2全部驱入C装置的碱石灰中,减小实验误差 B
【解析】
方案Ⅰ、样品溶液后加入盐酸,碳酸钠和盐酸反应生成氯化钠溶液,碳酸氢钠与盐酸反应生成氯化钠溶液,蒸发结晶,称量固体质量,依据钠元素守恒进而求得碳酸钠的质量分数;
(1)蒸发结晶操作中,需要蒸发皿、酒精灯、玻璃棒等;
(2)根据测定方法分析,利用的是样品质量和反应后所得氯化钠的质量计算,过滤盐酸再蒸发浓缩时挥发,对测定结果无影响;
(3)若实验中测得样品质量为46.4g,固体质量为40.95g为氯化钠,根据钠元素守恒计算进而计算质量分数;
(4)蒸发结晶过程中若有固体飞溅,氯化钠质量减少,测定碳酸钠质量分数减小;
方案Ⅱ、称取一定量样品装入广口瓶中,打并止水夹,缓慢鼓入空气数分钟用来赶净装置中的空气,关闭止水夹,在干燥管内填满碱石灰,称量,缓慢加入稀硫酸至不再产生气体为止,打开止水夹,缓慢鼓入空气数分钟,把生成的二氧化碳全部赶到碱石灰干燥管中全部吸收,再称量干燥管质量,通过碱石灰的增重求得二氧化碳的质量,根据二氧化碳的质量和样品质量求得碳酸钠的物质的量,进而求得质量分数;
(5)在C中装碱石灰来吸收净化后的气体,测定生成气体质量,该方案关键是要获得产生的CO2的质量,故应保证产生的二氧化碳完全被吸收,而空气中二氧化碳不能被吸收,装置D是防止空气中的气体进入装置C;
(6)所以反应前后都要通入N2,反应后通入N2的目的是:排尽装置内的空气,将生成的二氧化碳从容器内排出,被C装置中碱石灰吸收;
方案Ⅲ:气体分析法
(7)所选液体不溶解二氧化碳。
(1)蒸发结晶操作中,需要蒸发皿、酒精灯、玻璃棒等;
故答案为:蒸发皿、玻璃棒;
(2)利用的是样品质量和反应后所得氯化钠的质量计算,过滤盐酸再蒸发浓缩时挥发,对测定结果无影响,改为“过量盐酸”,便于操作且不影响测定的准确性,因盐酸易挥发,过量的盐酸在加热过程中挥发不残留,不影响结果;
故答案为:因盐酸易挥发,过量的盐酸在加热过程中挥发不残留,不影响结果;
(3)设碳酸钠的物质的量为xmol、碳酸氢钠的物质的量为ymol,则![]() ,解得x=0.2mol,y=0.3mol;碳酸钠的质量分数为
,解得x=0.2mol,y=0.3mol;碳酸钠的质量分数为![]() 45.7%;
45.7%;
(4)由于碳酸钠中钠的质量分数大于碳酸氢钠,所以蒸发结晶过程中若有固体飞溅,测得碳酸钠的质量分数偏小;
(5)方案Ⅱ是根据二氧化碳的质量测碳酸钠的质量分数,D装置的作用是吸收空气中的水蒸气和二氧化碳,以确保前一个干燥管中质量增加量的准确性;
(6)反应后通入N2的目的是将B、C装置中残留CO2全部驱入C装置的碱石灰中,减小实验误差;
(7) 利用测定反应生成的二氧化碳气体体积的方法测定,在碳酸氢钠溶液中二氧化碳不反应,溶解度减小,利用装置图排饱和碳酸氢钠溶液测定二氧化碳气体的体积,二氧化碳和碳酸钠、氢氧化钠都反应,在硫酸铜溶液中也溶解;
故答案为:B。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案