题目内容
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)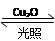 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
下列说法不正确的是 ( )。
A.前20 min内的平均反应速率v(H2O)=5.0×10-5 mol·L-1·min-1
B.达到平衡时,至少需要从外界吸收能量0.968 kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关
C
解析

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
在密闭容器中存在如下反应:A (g)+3B(g) 2C(g);△H<0,某研究小组研究了只改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:

下列判断一定错误的是
| A.图Ⅰ研究的是压强对反应的影响,且乙的压强较高 |
| B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高 |
| C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
| D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用催化剂的效率较高 |
反应CO+H2O(g) CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是
CO2+H2在724℃达到平衡时,分别改变下列条件,K值发生变化的是
| A.将压强减小至原来的一半 | B.将反应温度升高 |
| C.添加催化剂 | D.增大水蒸气的浓度 |
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)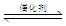 2CO2(g)+S(l) △H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l) △H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
| A.平衡前,随着反应的进行,容器内压强始终不变 |
| B.平衡时,其他条件不变,分离出硫,正反应速率加快 |
| C.平衡时,其他条件不变,升高温度可提高SO2的转化率 |
| D.其他条件不变,使用不同催化剂,该反应的平衡常数不变 |
纳米钴(Co)常用于CO加氢反应的催化剂,500 K时有催化反应:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
| A.纳米技术的应用,提高了催化剂的催化性能 |
| B.缩小容器体积,平衡向正反应方向移动,CO的浓度减小 |
| C.温度越低,越有利于CO催化加氢 |
| D.从平衡体系中分离出H2O(g)能加快正反应速率 |
对于可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是 ( )。
4NO(g)+6H2O(g),下列叙述正确的是 ( )。
| A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=4∶5 |
| B.反应达到平衡时,对体系充入稀有气体并加压,平衡总是向逆反应方向移动 |
| C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动 |
| D.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡 |
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) ΔH>0;该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )。
MgO(s)+CO2(g)+SO2(g) ΔH>0;该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )。
| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
下列反应中符合下图图像的是( )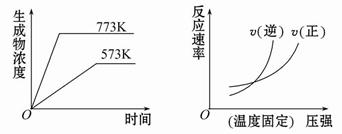
A.N2(g)+3H2(g) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0) 2NH3(g) ΔH=-Q1 kJ·mol-1(Q1>0) |
B.2SO3(g) 2SO2(g)+O2(g) ΔH=+Q2 kJ·mol-1(Q2>0) 2SO2(g)+O2(g) ΔH=+Q2 kJ·mol-1(Q2>0) |
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-Q3 kJ·mol-1(Q3>0) 4NO(g)+6H2O(g) ΔH=-Q3 kJ·mol-1(Q3>0) |
D.H2(g)+CO(g) C(s)+H2O(g) ΔH=+Q4 kJ·mol-1(Q4>0) C(s)+H2O(g) ΔH=+Q4 kJ·mol-1(Q4>0) |
 CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法中正确的是( )
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法中正确的是( )