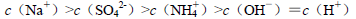题目内容
对于可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是 ( )。
4NO(g)+6H2O(g),下列叙述正确的是 ( )。
| A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=4∶5 |
| B.反应达到平衡时,对体系充入稀有气体并加压,平衡总是向逆反应方向移动 |
| C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动 |
| D.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡 |
A
解析

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
将2mol H2和1mol CO2充入体积为10L的恒容密闭容器中,在一定条件下发生反应:
①CO2(g)+ H2(g) CO(g) + H2O(g) △H1=+41.2kJ·moL-1;
CO(g) + H2O(g) △H1=+41.2kJ·moL-1;
②CO2(g)+ 3H2(g) CH3OH(g) + H2O(g) △H2=-49kJ·moL-1。
CH3OH(g) + H2O(g) △H2=-49kJ·moL-1。
反应100min后达到平衡,测得下表数据:
| 温度 | 转化率(%) | 物质的量(mol) | ||
| H2 | CO2 | CH3OH | CO | |
| 240℃ | | 10 | 0.05 | 0.05 |
下列说法正确的是
A.升高温度,反应①的平衡常数减小
B.升高温度,CH3OH的含量提高
C.H2转化率为10%
D.100min内,反应②的速率为v(CO2)=0.0001 mol·L-1·min-1
一定条件下,在密闭容器中进行如下反应: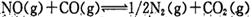
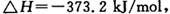 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 |
| B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 |
| D.增大压强同时充入NO |
在其它条件不变时,10℃时以某物质表示的反应速率为3 mol?(L· s )-1,已知温度每升高10℃反应速率是原来的2倍,则温度为50℃时,该反应的速率为
| A.48 mol?(L· s )-1 | B.36 mol?(L· s )-1 |
| C.24 mol?(L· s )-1 | D.12 mol?(L· s )-1 |
在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g)  2SO3(g) △H<0,n(SO2)随时间的变化如表:
2SO3(g) △H<0,n(SO2)随时间的变化如表:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 3 |
| n(SO2)/mol | 0.20 | 0.1 6 | 0.13 | 0.11 | 0.08 | 0.08 |
则下列说法正确的是
A.当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
B.用O2表示0~4min内该反应的平均速率为0.005mol/(L·min)
C.若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
D.平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大
已知反应4NH3+5O2 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是 ( )。
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是 ( )。
A.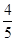 v(NH3)=v(O2) v(NH3)=v(O2) |
B.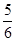 v(O2)=v(H2O) v(O2)=v(H2O) |
C.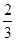 v(NH3)=v(H2O) v(NH3)=v(H2O) |
D.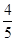 v(O2)=v(NO) v(O2)=v(NO) |
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)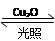 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
下列说法不正确的是 ( )。
A.前20 min内的平均反应速率v(H2O)=5.0×10-5 mol·L-1·min-1
B.达到平衡时,至少需要从外界吸收能量0.968 kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关
已知反应4NH3+5O2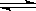 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是( )
A.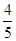 v(NH3)=v(O2) v(NH3)=v(O2) | B.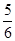 v(O2)=v(H2O) v(O2)=v(H2O) | C.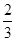 v(NH3)=v(H2O) v(NH3)=v(H2O) | D.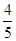 v(O2)=v(NO) v(O2)=v(NO) |
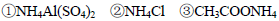
 由大到小的顺序是
由大到小的顺序是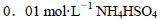 溶液中滴加NaOH溶液至中性:
溶液中滴加NaOH溶液至中性: