题目内容
【题目】甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡常数 | 温度(℃) | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+ CO2(g) | K3 | ||
(1)反应②是_________(填“吸热”或“放热”)反应。
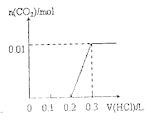
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图1所示。则平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”)。
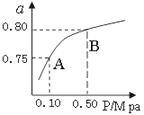
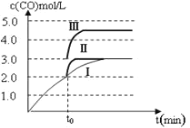
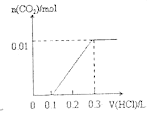
图 1 图2
(3)判断反应③△H____0; △S____0(填“>”“=”或“<”)在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol, 此时v(正)___v(逆)(填“>”“=”或“<”)
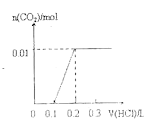
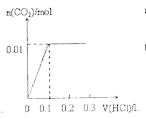
(4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知 c(CO)与反应时间t变化曲线Ⅰ如上图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸.常温条件下,将amol/L的CH3COOH与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________.
【答案】吸热 = < < > 加入催化剂 将容器的体积压缩至2L ![]()
【解析】
(1)随温度升高,反应②的平衡常数增大,说明升高温度平衡正向移动。
(2)平衡常数只与温度有关;
(3)反应①+反应②=反应③,所以K3= K1×K2;分别计算出反应③在500℃、800℃的平衡常数,根据平衡常数判断反应③的焓变;根据Q与K的关系判断反应进行方向。
(4)曲线Ⅰ变为曲线Ⅱ时,缩短达到平衡的时间,但平衡没移动;当曲线Ⅰ变为曲线Ⅲ时,CO的浓度突然变为原来的1.5倍,缩短达到平衡的时间,但平衡没移动;
(5)醋酸的电离常数![]() ,根据电荷守恒、物料守恒计算c(CH3COO-)、c(CH3COOH);根据电荷守恒,可判断此时溶液呈中性。
,根据电荷守恒、物料守恒计算c(CH3COO-)、c(CH3COOH);根据电荷守恒,可判断此时溶液呈中性。
(1)随温度升高,反应②的平衡常数增大,说明升高温度平衡正向移动,所以正反应吸热。
(2)平衡常数只与温度有关,某温度下反应①,平衡常数不变,所以K(A)=K(B);
(2)K3= K1×K2;在500℃时K3=2.5,800℃时K3=0.375,随温度升高,反应③的平衡常数减小,说明升高温度平衡逆向移动,所以正反应放热,△H<0;3H2(g)+ CO2(g)![]() CH3OH(g)+H2O (g)正方向气体物质的量减小,△S<0;在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,
CH3OH(g)+H2O (g)正方向气体物质的量减小,△S<0;在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,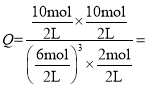 0.93<2.5,此时反应正向进行,v(正)>v(逆)。
0.93<2.5,此时反应正向进行,v(正)>v(逆)。
(4)反应②前后气体系数和不变,曲线Ⅰ变为曲线Ⅱ时,缩短达到平衡的时间,但平衡没移动,所以改变的条件是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时,CO的浓度突然变为原来的1.5倍,缩短达到平衡的时间,但平衡没移动,改变的条件是将容器的体积压缩至2L;
(5)常温条件下,将amol/L的CH3COOH与bmol/LBa(OH)2溶液等体积混合, 2c(Ba2+)=c(CH3COO-)=bmol/L,根据电荷守恒2c(Ba2+)+ c(H+)=c(CH3COO-)+ c(OH-),可知c(H+)= c(OH-)=![]() ,根据物料守恒c(CH3COO-)+c(CH3COOH)=
,根据物料守恒c(CH3COO-)+c(CH3COOH)=![]() mol/L,c(CH3COOH)=
mol/L,c(CH3COOH)=![]() ,醋酸的电离常数
,醋酸的电离常数![]() =
=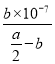 =
=![]() 。
。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。请填写下列空白:
Ⅰ.测定过氧化氢的含量
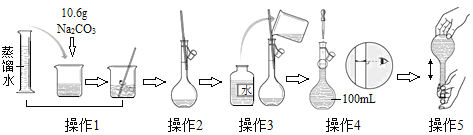
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL_______(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为________。
(3)判断滴定到达终点的现象是_________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
实验内容 | 实验方法 | 实验现象 |
验证氧化性 | ____________ | ____________ |
验证不稳定性 | ____________ | ____________ |