题目内容
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
| A.NF3分子中所有原子共平面 | B.NF3在反应中既做氧化剂又做还原剂 |
| C.生成0.2mol HNO3时转移0.2mol电子 | D.氧化产物与还原产物的物质的量之比为2∶1 |
B
解析试题分析:A、NF3的结构类似于NH3,为三角锥,不共面,错误;B、NF3中N元素的化合价为+3,部分升高为+5价,部分降低为+2价,既做氧化剂又做还原剂,正确;C、生成0.2mol HNO3时转移电子:0.2mol×2=0.4mol,错误;D、氧化产物为HNO3,还原产物为NO,所以氧化产物与还原产物的物质的量之比为1:2,错误。
考点:本题考查氧化还原反应的分析、物质的空间结构。

 步步高达标卷系列答案
步步高达标卷系列答案根据表中信息判断,下列选项不正确的是
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
某溶液中含有大量的Cl一、Br一、I一,若向l L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br一、I一的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,原溶液中Cl一、Br一、I一的物质的量浓度之比为( )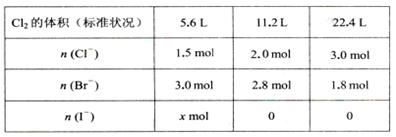
| A.5:15:4 | B.5:12:4 | C.15 : 30 : 8 | D.条件不足,无法计算 |
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。工业上可通过以下反应制得ClO2:2NaClO3+Na2SO3+H2SO4= 2ClO2↑+2Na2SO4 + H2O。下列说法正确的是
| A.氯元素的化合价升高 | B.Na2SO3是还原剂 |
| C.NaClO3发生氧化反应 | D.H2SO4被还原 |
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下: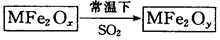
则下列判断正确的是
| A.MFe2Ox是还原剂 | B.SO2是该反应的催化剂 |
| C.x>y | D.SO2发生了置换反应 |
下列过程中不涉及氧化还原反应的是( )
| A.由植物油制备人造黄油 |
| B.用氯化铁溶液腐蚀印刷线路板 |
| C.用牺牲阳极的阴极保护法防止金属被腐蚀 |
| D.在蛋白质溶液中加入饱和硫酸铵溶液,析出白色固体 |
下列离子中,只有还原性的是
| A.H+ | B.Fe3+ | C.Cl— | D.SO32— |
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
| A.Cu与Cu2O 的物质的量之比为2:1 |
| B.硝酸的物质的量浓度为2.6mol/L |
| C.产生的NO在标准状况下的体积为4.48L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
下列化学反应中,属于置换反应的是
| A.NaOH + HCl ="NaCl" + H2O |
| B.H2CO3 =H2O + CO2 |
C.H2+CuO Cu + H2O Cu + H2O |
D.2CO + O2 2CO2 2CO2 |