题目内容
某溶液中含有大量的Cl一、Br一、I一,若向l L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br一、I一的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,原溶液中Cl一、Br一、I一的物质的量浓度之比为( )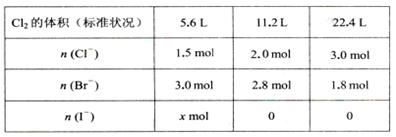
| A.5:15:4 | B.5:12:4 | C.15 : 30 : 8 | D.条件不足,无法计算 |
A
解析试题分析:通入氯气先发生反应Cl2 +2I一 = I2 +2Cl一 ,当I一 完全被氧化后发生反应Cl2 +2 Br一= Br2 +2Cl一 ,所以从反应方程式可以看出,反应一个I一、Br一 则生成一个Cl一 ,所以根据规律对比表格中前两组数据可以看出,通入11.2L氯气时,Cl一 增加0.5mol,Br一 消耗0.2mol,则同时消耗I一 0.3mol所以X为0.3,所以开始通入的5.6L氯气全部用于氧化I一 ,氧化I一 0.5mol,生成Cl一 0.5mol,所以可知开始时Cl一、Br一、I一 的物质的量分别为1.0mol、3.0mol、0.8mol,所以物质的量之比为5:15:4。故选A。
考点:本题考查的是

 金博士一点全通系列答案
金博士一点全通系列答案一定质量的镁、铝合金与硝酸溶液恰好完全反应,得硝酸盐溶液和NO2、N2O4、NO的混合气体,这些气体与标准状况下3.36L氧气混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸盐溶液中加入2mol/L NaOH溶液至沉淀最多时停止加入,将所产生沉淀滤出,向滤液加水稀释至500ml,此时所得溶液物质的量浓度为
| A.0.5mol/L | B.1mol/L | C.1.2mol/L | D.2mol/L |
某工厂利用FeCl3溶液腐蚀镀有铜的绝缘板生产电路板,一实验小组对该厂生产电路后所得的废液进行分析。取50.0 mL废液,向其中加入0.64 g Cu,金属铜全部溶解。另取50.0 mL废液,向其中加入足量的AgNO3,析出沉淀43.05 g,下列说法正确的是( )
| A.原废液中含有的金属阳离子只有Fe2+和Cu2+ |
| B.该工厂原来使用的FeCl3溶液的物质的量浓度约为2 mol/L |
| C.若向500 mL废液中加入足量的稀HNO3溶液,在标况下产生NO气体4.48 L,则原废液中Fe2+和Cu2+的物质的量浓度之比为2:1 |
| D.可以使用硫氰化钾溶液检验该废液中是否含有Fe2+ |
研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2。他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)( )
| A.0.448L | B.2.240L | C.2.016L | D.无法确定 |
为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是
| | 实验操作 | 实验现象 | 离子反应 | 实验结论 |
| A | 在氯化亚铁溶液中滴加新制氯水 | 浅绿色溶液变成棕黄色溶液 | 2Fe2++Cl2= 2Fe3++2Cl- | Fe2+具有还原性 |
| B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 | Fe2++Zn= Fe+Zn2+ | Zn具有还原性 |
| C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | Fe3++Fe= 2Fe2+ | 铁单质具有还原性 |
| D | 在氯化铁溶液中加入铜粉 | 蓝色溶液变成棕黄色溶液 | 2Fe3++Cu= 2Fe2++Cu2+ | Fe3+具有氧化性 |
一定条件下氨气和氧化铜可以发生如下反应:2NH3+3CuO 3Cu+N2+3H2O,对此反应的分析合理的是( )
3Cu+N2+3H2O,对此反应的分析合理的是( )
| A.该反应属置换反应 |
| B.CuO是氧化剂 |
| C.反应体现了金属铜的还原性 |
| D.每生成1molH2O就伴随着1mol电子转移 |
黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时的反应是:
S+2KNO3+3C=K2S+N2↑+3CO2↑,该反应的还原剂是
| A.C | B.C和S | C.KNO3 | D.S和KNO3 |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF。下列有关该反应的说法正确的是( )
| A.NF3分子中所有原子共平面 | B.NF3在反应中既做氧化剂又做还原剂 |
| C.生成0.2mol HNO3时转移0.2mol电子 | D.氧化产物与还原产物的物质的量之比为2∶1 |
铋(Bi)最高化合价为+5价,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色.现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应的现象如表所示:
| 加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A.NaBiO3、KMnO4、H2O2、I2 B.KMnO4、NaBiO3、H2O2、I2
C.I2、H2O2、KMnO4、NaBiO3 D.KMnO4、NaBiO3、I2、H2O2