题目内容
某密闭容器中发生如下反应 X(g)+3Y(g) 2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图所示,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。则下列说法中错误的是
2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图所示,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。则下列说法中错误的是

 2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图所示,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。则下列说法中错误的是
2Z(g)ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图所示,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。则下列说法中错误的是
| A.t2时加入了催化剂 |
| B.t3时减小了体系压强 |
| C.t5时升高了体系温度 |
| D.t2、t3、t5变化后反应物转化率均比t1时减小 |
D
试题分析:该反应的特点是放热反应,正向反应气体计量数减少。A、t2时正逆反应速率增大,平衡不移动,是加入催化剂,正确;B、t3时减小了体系压强,平衡逆向移动,正逆反应速率减少,正确;C、t5时升高了体系温度,正逆反应速率增大,平衡逆向移动,正确;D、.t2平衡不移动,转化率不变,t3、t5转化率减少,错误。

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目

 2C(g)(正反应吸热),下列图象正确的是
2C(g)(正反应吸热),下列图象正确的是
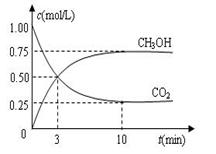
 (H2)= ;10min时,改变的外界条件可能是 .
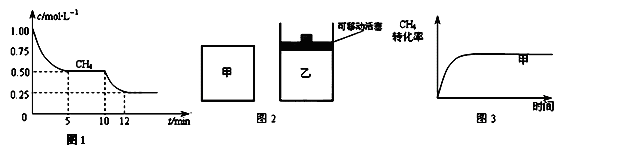
(H2)= ;10min时,改变的外界条件可能是 . 2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: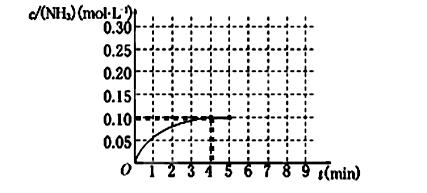
 ,测得CH4的平衡转化率与温度及压强的关系如图,下列有关说法一定正确的是
,测得CH4的平衡转化率与温度及压强的关系如图,下列有关说法一定正确的是
 2NH3(g),20 min后,N2的物质的量为1.9 mol,1 h后测得容器内气体的压强不再改变,且为反应开始时压强的0.8倍,则下列叙述正确的是( )
2NH3(g),20 min后,N2的物质的量为1.9 mol,1 h后测得容器内气体的压强不再改变,且为反应开始时压强的0.8倍,则下列叙述正确的是( ) cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率( υ)一时间(t)图象如下图。则下列说法中正确的是
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率( υ)一时间(t)图象如下图。则下列说法中正确的是 
 CH3CH2OH(g)。下图是乙烯的转化率随温度、压强的变化关系,下列说法正确的是( )
CH3CH2OH(g)。下图是乙烯的转化率随温度、压强的变化关系,下列说法正确的是( )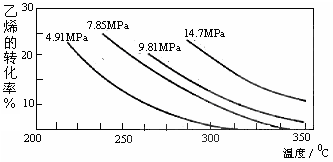
 CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表: CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入