题目内容
对于可逆反应A(g) + 2B(g) 2C(g)(正反应吸热),下列图象正确的是
2C(g)(正反应吸热),下列图象正确的是
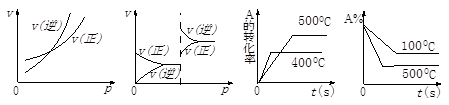
A B C D
 2C(g)(正反应吸热),下列图象正确的是
2C(g)(正反应吸热),下列图象正确的是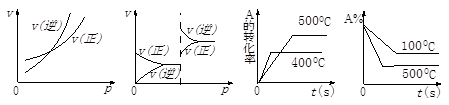
A B C D
D
试题分析:A、该反应是一个反应前后体积不变的反应,因此增大压强对正逆反应来讲是同等程度的改变大小,错误;B、错误跟A的原因一样;C、应该遵守“先拐先平,数值大”,错误;D、正确。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
题目内容
 2C(g)(正反应吸热),下列图象正确的是
2C(g)(正反应吸热),下列图象正确的是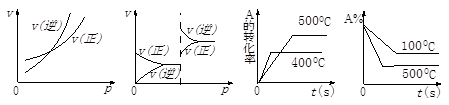

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案