题目内容
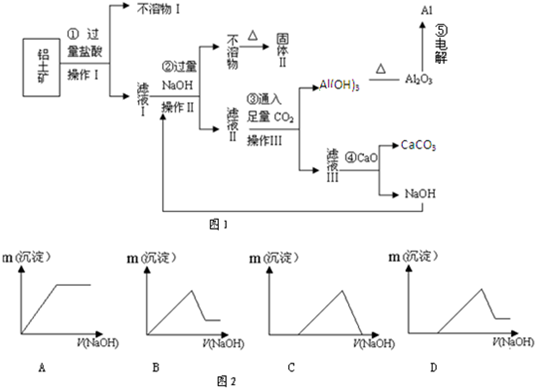
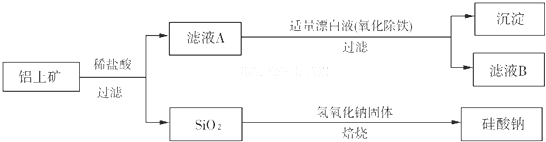
(16分)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
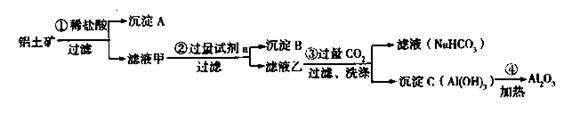
(1)沉淀A、B的成分分别是 、 ;
(2)步骤②中的试剂a是 ;
(3)试写出步骤③中发生反应的离子方式 ;
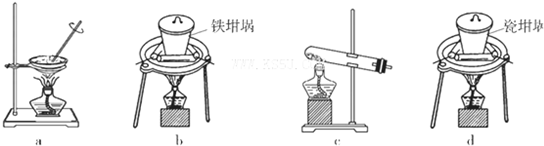
(4)在实验室模拟上述实验过程中,需要用到一定浓度的盐酸溶液。在配制250mi。该盐酸溶液时,某同学转移溶液的操作如图所示,图中的主要错误是:

① ;
② 。
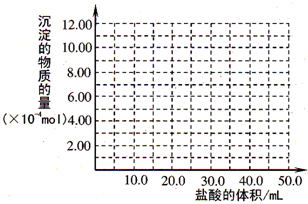
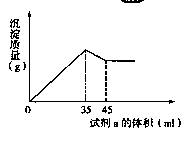
(4)准确称取6g铝土矿样品,加入100mL盐酸溶液,充分反应后向滤液中加入10 mol·L-1试剂a的溶液,产生沉淀的质量与加入试剂a的体积关系如图所示,则所用盐酸溶液的物质的量浓度为 ,样品中Al2O3的百分含量为 。
【答案】
(1)SiO2 Fe(OH)3(2分)
(2)NaOH溶液(2分)
(3)CO2+OH-
HCO3- CO2+A1(OH)4]-=Al(OH)3↓+HCO3-(4分)
(4)①未用玻璃棒引流;②未采用250 ml。容量瓶(4分)
(5)3.50mol·L-1(2分,不带单位不得分) 85%(2分,其它表示方式不得分)
【解析】

练习册系列答案
相关题目
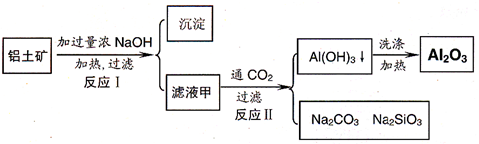
工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
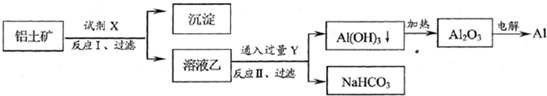
对上述流程中的判断正确的是( )

对上述流程中的判断正确的是( )
| A、试剂X为稀硫酸 | B、反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O→Al(OH)3↓+HCO3- | C、结合质子(H+)的能力由强到弱的顺序是:OH->AlO2->CO32- | D、Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |