题目内容
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有FeO、SiO2)中.工业上用铝土矿制备铝的某种化合物的工艺流程如下: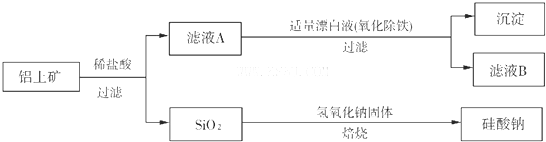
(l)滤液A所含溶质属于盐的是
(2)检验滤液B中是否还含有铁元素的方法为:
(3)将滤液B中的铝元素以沉淀形式析出,最佳试剂应选
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
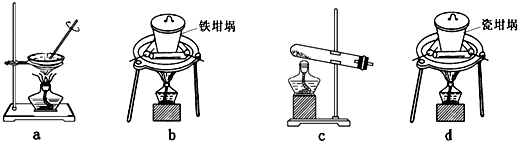
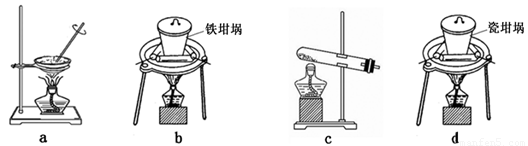
(4)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为
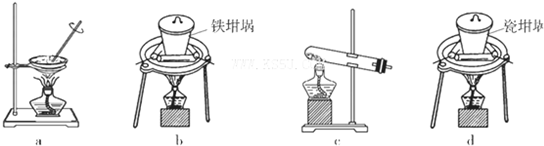
分析:(1)根据铝土矿的主要成分为Al2O3,还含有FeO、SiO2,及与过量盐酸反应后过滤得到滤液A,据此判断滤液A的成分;
(2)检验滤液B中是否还含有铁元素的方法为利用铁离子和亚铁离子的检验方法进行检验,先检验是否含铁离子,再检验是否含亚铁离子;
(3)滤液B中铝元素为氯化铝,依据氢氧化铝溶液强酸强碱,不溶于弱酸弱碱选择;
(4)a、蒸发皿中含有二氧化硅和氢氧化钠反应;
b、铁坩埚可以熔融二氧化硅和氢氧化钠;
c、玻璃中含二氧化硅和氢氧化钠反应;
d、瓷坩埚含有二氧化硅和氢氧化钠反应.
(2)检验滤液B中是否还含有铁元素的方法为利用铁离子和亚铁离子的检验方法进行检验,先检验是否含铁离子,再检验是否含亚铁离子;
(3)滤液B中铝元素为氯化铝,依据氢氧化铝溶液强酸强碱,不溶于弱酸弱碱选择;
(4)a、蒸发皿中含有二氧化硅和氢氧化钠反应;
b、铁坩埚可以熔融二氧化硅和氢氧化钠;
c、玻璃中含二氧化硅和氢氧化钠反应;
d、瓷坩埚含有二氧化硅和氢氧化钠反应.
解答:解:(1)铝土矿主要成分为Al2O3,还含有FeO、SiO2,铝土矿与过量盐酸反应后,二氧化硅不反应,而氧化铝和氧化亚铁与盐酸反应生成AlCl3、FeCl2,所以滤液A的主要成分为:AlCl3、FeCl2,
故答案为:AlCl3、FeCl2;
(2)滤液B中是否还含有铁元素的方法为利用铁离子和亚铁离子的检验方法进行检验,取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素,
故答案为:取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素;
(3)滤液中含有的是氯化铝溶液,将滤液B中的铝元素以沉淀形式析出,
a、氢氧化钠溶液可以沉淀铝离子但过量后会溶解氢氧化铝,故a错误;
b.硫酸溶液不能沉淀铝离子,故b错误;
c.过量的氨水和铝离子形成氢氧化铝沉淀,过滤得到氢氧化铝固体,故c正确;
d.二氧化碳和氯化铝不反应,无法生成氢氧化铝沉淀,故d错误;
故答案为:c;
(4)a、蒸发皿中含有的二氧化硅能够与氢氧化钠反应,不能用作SiO2和NaOH焙烧制备硅酸钠的装置,故a错误;
b、铁坩埚与二氧化硅和氢氧化钠都不反应,可以熔融二氧化硅和氢氧化钠,故b正确;
c、玻璃中含二氧化硅能够与氢氧化钠反应,不能用作SiO2和NaOH焙烧制备硅酸钠的装置,故c错误;
d、瓷坩埚含有的二氧化硅能够与氢氧化钠反应,不能用作SiO2和NaOH焙烧制备硅酸钠的装置,故d错误;
故答案为:b.
故答案为:AlCl3、FeCl2;
(2)滤液B中是否还含有铁元素的方法为利用铁离子和亚铁离子的检验方法进行检验,取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素,
故答案为:取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素;
(3)滤液中含有的是氯化铝溶液,将滤液B中的铝元素以沉淀形式析出,
a、氢氧化钠溶液可以沉淀铝离子但过量后会溶解氢氧化铝,故a错误;
b.硫酸溶液不能沉淀铝离子,故b错误;
c.过量的氨水和铝离子形成氢氧化铝沉淀,过滤得到氢氧化铝固体,故c正确;
d.二氧化碳和氯化铝不反应,无法生成氢氧化铝沉淀,故d错误;
故答案为:c;
(4)a、蒸发皿中含有的二氧化硅能够与氢氧化钠反应,不能用作SiO2和NaOH焙烧制备硅酸钠的装置,故a错误;
b、铁坩埚与二氧化硅和氢氧化钠都不反应,可以熔融二氧化硅和氢氧化钠,故b正确;
c、玻璃中含二氧化硅能够与氢氧化钠反应,不能用作SiO2和NaOH焙烧制备硅酸钠的装置,故c错误;
d、瓷坩埚含有的二氧化硅能够与氢氧化钠反应,不能用作SiO2和NaOH焙烧制备硅酸钠的装置,故d错误;
故答案为:b.
点评:本题考查了铁、铝性质的综合应用和氧化铝提纯制备流程分析应用,题目难度中等,注意蒸干灼烧熔融氢氧化钠的仪器选择方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目