题目内容
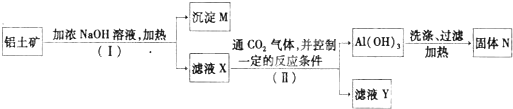
工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
对上述流程中的判断正确的是( )

对上述流程中的判断正确的是( )
| A、试剂X为稀硫酸 | B、反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O→Al(OH)3↓+HCO3- | C、结合质子(H+)的能力由强到弱的顺序是:OH->AlO2->CO32- | D、Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
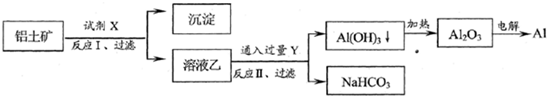
分析:A、根据流程可知,溶液乙通入过量的Y生成氢氧化铝沉淀、碳酸氢钠可知,溶液乙中含有偏铝酸根、气体Y为二氧化碳,则试剂X为氢氧化钠溶液;
B、过量的二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀与碳酸氢钠;
C、结合质子的能力越强,则形成的物质的酸性越弱;
D、氯化铝是分子晶体,熔融时不存在铝离子.
B、过量的二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀与碳酸氢钠;
C、结合质子的能力越强,则形成的物质的酸性越弱;
D、氯化铝是分子晶体,熔融时不存在铝离子.
解答:解:A、由于溶液乙通入过量的Y生成氢氧化铝沉淀、碳酸氢钠可知,溶液乙中含有偏铝酸根、气体Y为二氧化碳,故试剂X为氢氧化钠溶液,不可能为硫酸,故A错误;
B、过量的二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀与碳酸氢钠,反应方程式为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,离子方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,故B正确;
C、结合质子的能力就是指碱性,结合质子能力越强,相应的酸放出质子的能力就越弱,其对应的酸的酸性就越弱,显然酸性强弱HCO3->Al(OH)3>H2O,碱性:OH->AlO2->CO32-,所以结合质子能力:OH->AlO2->CO32-,故C正确;
D、氯化铝是分子晶体,熔融时不存在铝离子,电解熔融的氯化铝不能获得金属铝,故D错误;
故选BC.
B、过量的二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀与碳酸氢钠,反应方程式为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,离子方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,故B正确;
C、结合质子的能力就是指碱性,结合质子能力越强,相应的酸放出质子的能力就越弱,其对应的酸的酸性就越弱,显然酸性强弱HCO3->Al(OH)3>H2O,碱性:OH->AlO2->CO32-,所以结合质子能力:OH->AlO2->CO32-,故C正确;
D、氯化铝是分子晶体,熔融时不存在铝离子,电解熔融的氯化铝不能获得金属铝,故D错误;
故选BC.
点评:本题考查了铁、铝化合物的性质以工业冶炼铝等,题目难度中等,理解工艺原理,根据工艺流程判断试剂X为氢氧化钠是解题关键.

练习册系列答案
相关题目