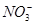题目内容
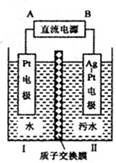
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是
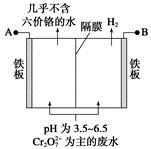

| A.A为电源正极 |
| B.阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O |
| C.阴极区附近溶液pH降低 |
| D.若不考虑气体的溶解,当收集到H213.44 L(标准状况)时,有0.1 mol Cr2O72-被还原 |
C
根据图示,A作阳极,B作阴极,电极反应式为
阳极:Fe-2e-=Fe2+
阴极:2H++2e-=H2↑
然后,Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O
由于在阴极区c(H+)减小,pH增大。根据6H2~6Fe2+~Cr2O72-得,当有13.44 L(标准状况)H2放出时,应有0.1 mol Cr2O72-被还原。
阳极:Fe-2e-=Fe2+
阴极:2H++2e-=H2↑
然后,Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O
由于在阴极区c(H+)减小,pH增大。根据6H2~6Fe2+~Cr2O72-得,当有13.44 L(标准状况)H2放出时,应有0.1 mol Cr2O72-被还原。

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目