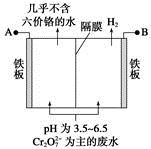
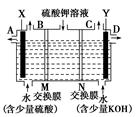
题目内容
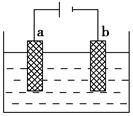
以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2 mol Fe(OH)3沉淀。此过程中共消耗水 ( )
| A.3 mol | B.4 mol | C.5 mol | D.6 mol |
C
铁为阳极,则Fe-2e-=Fe2+,阴极反应为:2H2O+2e-=H2↑+2OH-,生成的Fe2+与溶液中的OH-反应生成Fe(OH)2,Fe2++2OH-=Fe(OH)2↓,Fe(OH)2不稳定,被空气中的氧气氧化生成Fe(OH)3沉淀,即4Fe(OH)2+2H2O+O2=4Fe(OH)3,所以得到2 mol Fe(OH)3沉淀时,共消耗水的物质的量为5 mol,即选C。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目