题目内容
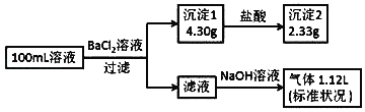
【题目】将1.95g由Na2SO4和Na2CO3组成的混合物溶于水得溶液A,在A中加入10mL未知的BaCl2溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀盐酸,充分反应后剩余沉淀2.33g。计算:
(1)原混合物中Na2SO4的物质的量___。
(2)碳酸钠的质量分数___。
【答案】0.01mol 27.2%
【解析】
将Na2SO4和Na2CO3组成的混合物溶于水,加入未知浓度的BaCl2溶液恰好完全反应,发生Na2SO4+BaCl2=BaSO4↓+2NaCl,Na2CO3+BaCl2=BaCO3↓+2NaCl,沉淀B为硫酸钡、碳酸钡,在沉淀B中加入足量稀盐酸,发生反应BaCO3+2HCl=BaCl2+CO2↑+H2O,碳酸钡溶解,剩余沉淀2.33g为BaSO4,由方程式可计算原混合物中Na2SO4的质量,进而计算Na2CO3的质量分数。
将Na2SO4和Na2CO3组成的混合物溶于水,加入未知浓度的BaCl2溶液恰好完全反应,发生Na2SO4+BaCl2=BaSO4↓+2NaCl,Na2CO3+BaCl2=BaCO3↓+2NaCl,加入足量稀盐酸,发生反应BaCO3+2HCl=BaCl2+CO2↑+H2O,碳酸钡溶解,剩余沉淀2.33g为BaSO4;
(1)设混合物中Na2SO4的质量为x,则:

则![]() ,解得x=1.42g,故混合物中Na2SO4的质量为1.42g,物质的量为:
,解得x=1.42g,故混合物中Na2SO4的质量为1.42g,物质的量为:![]() ,故答案为0.01mol;
,故答案为0.01mol;
(2)由(1)可知:混合物中碳酸钠的质量=1.95g-1.42g=0.53g,则碳酸钠的质量分数=![]() ,故答案为27.2%。
,故答案为27.2%。

练习册系列答案
相关题目