题目内容
【题目】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:Ⅰ.2SO2(g) + O2(g)![]() 2SO3(g)ΔH=-196.6 kJ· mol-1
2SO3(g)ΔH=-196.6 kJ· mol-1
Ⅱ.2NO(g) + O2(g) ![]() 2NO2(g)ΔH=-113.0 kJ· mol-1
2NO2(g)ΔH=-113.0 kJ· mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=____kJ· mol-1。
SO3(g)+NO(g)的ΔH=____kJ· mol-1。
(2)一定条件下,将NO2(g)与SO2(g)以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1 mol SO3的同时生成1 mol NO
(3)CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示,该反应的ΔH____0(填“>”或“<”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示,该反应的ΔH____0(填“>”或“<”)。

(4)依据燃烧的反应原理,合成的甲醇可以设计成如图乙所示的原电池装置。
①该电池工作时,OH-向____(填“正”或“负”)极移动。
②该电池正极的电极反应式为___________。
【答案】-41.8BD<负2H2O+O2+4e-![]() 4OH-
4OH-
【解析】
(1)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2![]() 2SO3+2NO, △H=-83.6 kJ·mol-1,则NO2+SO2
2SO3+2NO, △H=-83.6 kJ·mol-1,则NO2+SO2![]() SO3+NO △H=-41.8 kJ·mol-1;
SO3+NO △H=-41.8 kJ·mol-1;
(2)A.本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,不能说明反应已达到平衡状态,A错误;B.随着反应的进行,NO2的浓度减小,颜色变浅,可以说明反应已达平衡,B正确;C.SO3和NO都是生成物,比例保持1:1,不能作为平衡状态的判断依据,C错误;D.所述的两个速率分别表示正逆反应速率,能作为平衡状态的判断依据,D正确,答案选BD;
(3)由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;
(4)①在原电池中,电解质溶液中的阴离子向负极移动,所以OH-向负极移动。
②该电池正极是氧气得到电子,电解质溶液显碱性,则电极反应式为2H2O+O2+4e-=4OH-。

【题目】甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是
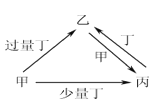
选项 | 甲 | 乙 | 丙 | 丁 |
A | NaOH | NaHSO3 | Na2SO3 | SO2 |
B | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 |
C | C | CO2 | CO | O2 |
D | Al | NaAlO2 | Al(OH)3 | NaOH |
A. A B. B C. C D. D