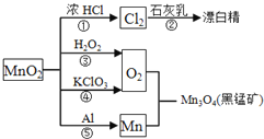
题目内容
【题目】常温常压下,将三个分别盛满氨气、氯化氢、二氧化氮的等容积烧瓶倒置于盛有水的水槽中,当水进入烧瓶中,并使气体充分溶解后(假设烧瓶中的溶液不向外扩散),三种溶液的物质的量浓度之比为( )
A. 1∶1∶1B. 3∶3∶2
C. 1∶2∶3D. 1∶1∶2
【答案】A
【解析】
相同条件下,等体积的气体物质的量相同,氨气、氯化氢极易溶于水,盛有等体积氨气、氯化氢的烧瓶倒置于盛有水的水槽中,水会充满烧瓶;二氧化氮和水反应的方程式是3NO2+H2O=2HNO3+NO,根据方程式可知水会充入烧瓶的![]() ;根据c=
;根据c=![]() 计算溶液浓度。
计算溶液浓度。
将三个分别盛满氨气、氯化氢、二氧化氮的等容积烧瓶倒置于盛有水的水槽中,盛有等体积氨气、氯化氢的烧瓶倒置于盛有水的水槽中,水会充满烧瓶;二氧化氮和水反应的方程式是3NO2+H2O=2HNO3+NO,根据方程式可知水会充入烧瓶的![]() ,溶液中的溶质是硝酸,硝酸物质的量是NO2的
,溶液中的溶质是硝酸,硝酸物质的量是NO2的![]() ;
;
相同条件下,等体积的气体物质的量相同,令气体物质的量是amol,烧瓶体积是vL,三种溶质的物质的量分别是n(NH3)=n(HCl)= amol,n(HNO3)= ![]() amol,三种溶液的体积分别是 V(氨水)=V(盐酸)= vL,V(HNO3溶液)=
amol,三种溶液的体积分别是 V(氨水)=V(盐酸)= vL,V(HNO3溶液)= ![]() vL,根据c=
vL,根据c=![]() ,c(NH3·H2O)=c(HCl)=c(HNO3)=
,c(NH3·H2O)=c(HCl)=c(HNO3)=![]() mol/L,所以浓度比为1:1:1,故选A。
mol/L,所以浓度比为1:1:1,故选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】如何除去下列物质中的杂质,请在相关栏目内填表
含杂质物质 | 除杂试剂或方法 | 有关反应的化学方程式 |
(1)NO(NO2 ) | ______ | ______ |
(2)SiO2(CaCO3) | ______ | ______ |
(3)SO2 (HCl ) | ______ | ______ |
(4)Na2CO3固体(NaHCO3) | ______ | ______ |