题目内容
【题目】碲(Te)是VIA族非金属元素,其单质和化合物在太阻能、电子、橡胶生产方面具有广泛的应用。
(1)根据碲(Te)在元素周期表中的位置,判断H2TeO4的酸性_____(填“大于”、“小于”或“无法判断”)H2SO4酸性。
(2)己知TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。TeO2和NaOH溶液发生反应的化学方程式为_________________。
(3)已知25℃时,亚碲酸(H2TeO3)的电离常数K1=1×10-3,K2=2×10-8。计算:
①0.1mol/L H2TeO3的电离度α约为_______(α=已电离弱电解质分子数/电解质分子总数×100%);
②NaHTeO3溶液的pH_____7(填“>”、“=”或“<”)。
(4)从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一和工芝流程如下:
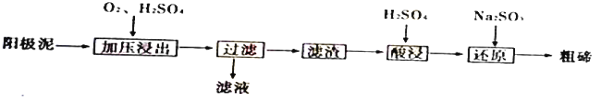
③己知加压酸浸时控制溶液的pH为5.0,生成TeO2沉淀。如果H2SO4溶液浓度过大,将导致TeO2沉淀不完全,原因是_____________。
④防止局部酸度过大的操作方法是___________。
⑤对滤渣“酸浸”后,将Na2SO3加入Te(SO4)2溶液中进行“还原”得到固态碲,该反应的离子方程式是____________。
⑥“还原”得到固态碲后分离出粗碲的方法是________,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是_____________。
【答案】 小于 TeO2+2NaOH=Na2TeO3+H2O 10% < 溶液酸性过强,TeO2会继续与酸反应,导致TeO2沉淀不完全 搅拌 2SO32-+Te4++2H2O=Te↓+2SO42-+4H+ 过滤 取少量最后一次洗涤液,加入BaCl2溶液,若没有白色沉淀生成,则说明洗涤干净
【解析】分析:(1)根据元素周期律分析;
(2)TeO2是两性氧化物,与氢氧化钠发生类似氧化铝与氢氧化钠的反应;
(3)①根据根据电离度的概念结合电离常数计算;
②利用水的离子积常数、电离常数计算其水解常数,与其相应的电离常数比较,从而判断酸式盐溶液的酸碱性;
(3)粗铜精炼的阳极泥(主要含有Cu2Te),通入氧气加入硫酸加压浸出,已知加压酸浸时控制溶液的PH为5.0,生成TeO2沉淀,过滤得到滤渣加入硫酸酸浸生成硫酸碲,加入亚硫酸钠还原得到粗碲。
③根据TeO2是两性氧化物分析;
④防止局部酸度过大可以通过搅拌使之混合均匀;
⑤Na2SO3还原Te(SO4)2为Te,本身被氧化为硫酸钠,根据得失电子守恒书写;
⑥分离固体和溶液用过滤,对粗碲进行洗涤,判断洗涤干净的实验操作是检验最后一次洗涤液中是否含硫酸根离子。
详解:(1)Te与S位于同一主族,同主族从上到下非金属性逐渐减弱,最高价含氧酸的酸性逐渐减弱,则H2TeO4的酸性小于H2SO4酸性;
(2)TeO2是两性氧化物,与氢氧化钠发生类似氧化铝与氢氧化钠的反应,因此反应的化学方程式为TeO2+2NaOH=Na2TeO3+H2O;
(3)已知25℃时,亚碲酸(H2TeO3)的电离常数K1=1×10-3,K2=2×10-8。計算:
①亚碲酸以第一步电离为主,0.1mol/L H2TeO3溶液中c(H+)=c(HTeO3-)=![]() ,所以其电离度α约为
,所以其电离度α约为![]() ;
;
②NaHTeO3溶液中HTeO3-的水解常数是![]() <K2=2×10-8,即水解程度小于电离程度,所以溶液显酸性,即pH<7。
<K2=2×10-8,即水解程度小于电离程度,所以溶液显酸性,即pH<7。
(3)③因为TeO2是两性氧化物,H2SO4过量会导致TeO2继续与H2SO4反应导致损失,导致TeO2沉淀不完全;
④防止局部酸度过大的操作方法是搅拌;
⑤对滤渣“酸浸后,将Na2SO3加入Te(SO4)2溶液中进行还原得到固态碲,根据电子得失守恒、原子守恒以及电荷守恒可知该反应的离子方程式是2SO32-+Te4++2H2O=Te↓+2SO42-+4H+;
⑥还原得到固态碲后分离出粗碲的方法是过滤,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是:取少量最后一次洗涤液,加入BaCl2溶液,若没有白色沉淀生成,则说明洗涤干净。

 阅读快车系列答案
阅读快车系列答案【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
HCN | S8 | SF6 | B12结构单元 | |
结构模型 示意图 |
|
|
|
|
备注 | — | 易溶于CS2 | — | 熔点1 873 K |
A. HCN的结构式为H—C≡N,分子中含有2个σ键和2个π键
B. 固态硫S8属于原子晶体
C. SF6是由极性键构成的非极性分子
D. 单质硼属原子晶体,结构单元中含有30个B—B键