题目内容
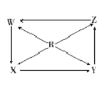
【题目】如图R、W、X、Y、Z为五种物质,若箭头表示能进一步转化的常见反应,则其中常温下能实现图示转化关系的是( )
选项 | R | W | X | Y | Z |
|
A | Si | SiO2 | H2SiO3 | NaSiO3 | SiCl4 | |
B | Na | Na2O | Na2O2 | Na2CO3 | NaOH | |
C | Fe | Fe(OH)2 | FeCl2 | FeCl3 | Fe(NO3)3 | |
D | Al | NaAlO2 | Al2(SO4)3 | AlCl3 | Al(NO3)3 |
【答案】D
【解析】
试题分析:A.Si与O2加热反应产生SiO2,SiO2难溶于水,不能与水发生反应产生H2SiO3,错误;B.Na在空气中加热被氧化产生Na2O2,但是Na不能反应直接变为Na2CO3,错误;C.Fe不能与物质直接反应产生Fe(OH)2,错误;D.Al与NaOH溶液发生反应产生NaAlO2;与硫酸反应产生Al2(SO4)3;与盐酸或氯气发生反应产生AlCl3,与硝酸发生反应产生Al(NO3)3,都可以一步完成上述转化关系,正确。

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目