题目内容
【题目】Ⅰ:现有下列7种物质:①NaHCO3②CH3COOH③BaSO4;④HF;⑤C2H5OH;⑥Al;⑦食盐水.其中属于强电解质的是 (填序号,下同),既能跟盐酸反应又能跟NaOH溶液反应的是 .
II:现有一瓶浓度为0.2mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种,为了确定该酸溶液的组成进行实验:取20.00mL该酸溶液,逐滴加入0.2mol/L的氢氧化钠溶液,恰好反应完全时所需碱液体积为20.00mL,请用化学用语回答:
(1)该酸不可能是 ;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为 ,用离子方程式说明溶液呈碱性的原因 ;
【答案】
I.①③;①⑥;
Ⅱ.(1)H2SO4;(2)醋酸;CH3COO-+H2O![]() CH3COOH+OH-。
CH3COOH+OH-。
【解析】
试题分析:I.食盐水属于混合物,Al属于单质,二者既不是电解质也不是非电解质,NaHCO3、BaSO4属于强电解质,HF、CH3COOH属于弱电解质,C2H5OH属于非电解质;NaHCO3、Al既能跟盐酸反应又能跟NaOH溶液反应,故答案为:①③;①⑥;
Ⅱ.(1)某酸的物质的量为0.2mol/L×0.02L=0.004mol,氢氧化钠的物质的量0.02L×0.2mol/L=0.004mol,酸和碱的物质的量之比1:1,所以酸为一元酸,不可能为H2SO4,故答案为:H2SO4;
(2)溶液呈碱性,说明该酸溶液为弱酸,只能为醋酸溶液,醋酸与氢氧化钠反应生成醋酸钠,醋酸根离子水解:CH3COO-+H2O![]() CH3COOH+OH-,故答案为:醋酸;CH3COO-+H2O
CH3COOH+OH-,故答案为:醋酸;CH3COO-+H2O![]() CH3COOH+OH-。
CH3COOH+OH-。

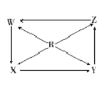
【题目】如图R、W、X、Y、Z为五种物质,若箭头表示能进一步转化的常见反应,则其中常温下能实现图示转化关系的是( )
选项 | R | W | X | Y | Z |
|
A | Si | SiO2 | H2SiO3 | NaSiO3 | SiCl4 | |
B | Na | Na2O | Na2O2 | Na2CO3 | NaOH | |
C | Fe | Fe(OH)2 | FeCl2 | FeCl3 | Fe(NO3)3 | |
D | Al | NaAlO2 | Al2(SO4)3 | AlCl3 | Al(NO3)3 |
【题目】下列关于物质分类的正确组合是( )
类别 组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | SiO2 | H2SO4 | KOH | NaHCO3 |
B | CO | Na2O | HCl | NaOH | NaCl |
C | SO2 | CuO | CH3COOH | Na2CO3 | CaF2 |
D | SO3 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A. A B. B C. C D. D
【题目】体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果。某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究。
已知:MgO+2HCl=MgCl2+H2O MgCO3+2HCl=MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有______。

②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是______________。小明按照修改后的实验方案重复上述实验,观察到b试管中无明显现象,证明“镁粉”中______________。
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5g三种固体粉末,每次取样方法如图2所示:

逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
MgO | Mg(OH)2 | MgCO3 | |
消耗稀盐酸的体积 /mL | 10.4 | 7.2 | 5.0 |
Mg(OH)2与盐酸发生中和反应的化学方程式为_____________。
Ⅱ.取“镁粉”样品0.5 g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3 mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是____________________________________。
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5 g“镁粉”和0.5 g_________,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL。由此可知“镁粉”中含有MgCO3的质量分数为___________。