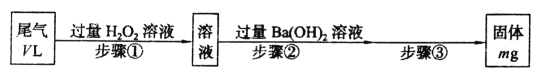
题目内容
【题目】 ⑴已知碳酸二级电离较偏铝酸的电离容易,而石炭酸的电离介于碳酸的一级电离与二级电离之间。下面的推论正确的是_________________:
①将CO2通入偏铝酸钠溶液中,溶液变浑浊,并生成碳酸钠或碳酸氢钠;②将CO2通入C6H5ONa溶液中,离子反应式为CO2+H2O+2C6H5O—![]() 2 C6H5OH+CO32—;
2 C6H5OH+CO32—;
③HCO3—在溶液中既能与AlO2—又能与Al3+反应,且都发生双水解;④往含有大量CO32—的溶液中加入C6H5OH得到澄清溶液,放出CO2气体;⑤向Al(OH)3的混浊液中加入Na2CO3溶液得不到澄清溶液;⑥相同温度,相同浓度的Na2CO3、C6H5ONa、NaHCO3、NaAlO2的稀溶液PH依次增大。
(2)浅绿色的Fe(NO3)2溶液中,存在如下平衡:Fe2++2H2O![]() Fe(OH) 2+2H+若在此溶液中加入盐酸后,用文字说明溶液颜色的变化及原因__________________.
Fe(OH) 2+2H+若在此溶液中加入盐酸后,用文字说明溶液颜色的变化及原因__________________.
⑶一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-=Cu2+,还原反应式:2Fe3++2e-=2Fe2+。据此,回答下列问题:
①将反应3 Cu+8H+ +2NO3-=3Cu2++2NO↑+4H2O拆写为两个“半反应式”:
还原反应式: 。
②已知某反应的两个“半反应式”为:
CH4+10 OH--8e-=CO32-+7H2O, O2+2H2O+4e-= 4OH-,
则氧化还原反应方程式为 。
③此原理可用于电化学。锌—锰碱性电池广泛应用于日常生活。电池的总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。
该电池的正极反应式为 。
【答案】
(1)①⑤;
(2)溶液有浅绿色变为棕黄色,Fe2+被(H+和NO3-的组合)氧化为Fe3+
(3)①8H+ +2NO3-+6e-=2NO↑+4H2O
②CH4+2OH-+2O2-=CO32-+3H2O
③2MnO2+2H2O+2e- == 2MnOOH+2OH-
【解析】
试题分析:⑴已知碳酸二级电离较偏铝酸的电离容易,而石炭酸的电离介于碳酸的一级电离与二级电离之间,表示酸性:碳酸>石炭酸>碳酸氢根离子>偏铝酸。①因为酸性碳酸>碳酸氢根离子>偏铝酸,将CO2通入偏铝酸钠溶液中,溶液变浑浊,并生成碳酸钠或碳酸氢钠,正确;②因为酸性石炭酸>碳酸氢根离子将CO2通入C6H5ONa溶液中,离子反应式为CO2+H2O+C6H5O—→2C6H5OH+HCO3—,错误;③HCO3—在溶液中能与AlO2—反应属于强酸制弱酸,与Al3+发生双水解反应,错误;④因为酸性碳酸>石炭酸,往含有大量CO32—的溶液中加入C6H5OH得到澄清溶液,不能CO2气体,错误⑤因为酸性碳酸氢根离子>偏铝酸,向Al(OH)3的混浊液中加入Na2CO3溶液不发生反应,得不到澄清溶液,正确;⑥因为酸性:碳酸>石炭酸>碳酸氢根离子>偏铝酸,相同温度,相同浓度的Na2CO3、C6H5ONa、NaHCO3、NaAlO2的稀溶液,NaHCO3的pH依次最小,错误,故选①⑤;
(2)在平衡:Fe2++2H2O![]() Fe(OH) 2+2H+,加入盐酸后,H+和NO3-的组合将Fe2+氧化为Fe3+,溶液有浅绿色变为棕黄色,故答案为:溶液有浅绿色变为棕黄色,Fe2+被(H+和NO3-的组合)氧化为Fe3+;
Fe(OH) 2+2H+,加入盐酸后,H+和NO3-的组合将Fe2+氧化为Fe3+,溶液有浅绿色变为棕黄色,故答案为:溶液有浅绿色变为棕黄色,Fe2+被(H+和NO3-的组合)氧化为Fe3+;
⑶一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-=Cu2+,还原反应式:2Fe3++2e-=2Fe2+。据此,回答下列问题:
①反应3 Cu+8H+ +2NO3-=3Cu2++2NO↑+4H2O,其中Cu元素的化合价升高,被氧化,N元素的化合价降低,被还原,还原反应式为8H+ +2NO3-+6e-=2NO↑+4H2O,故答案为:8H+ +2NO3-+6e-=2NO↑+4H2O;
②已知某反应的两个“半反应式”为:CH4+10 OH--8e-=CO32-+7H2O……①,O2+2H2O+4e-= 4OH-……②,将①+②×2,得:CH4+2OH-+2O2-=CO32-+3H2O,故答案为:CH4+2OH-+2O2-=CO32-+3H2O;
③电池的总反应式为Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s),其中锰元素的化合价降低,发生还原反应,该电池的正极反应式为2MnO2+2H2O+2e- == 2MnOOH+2OH-,故答案为:2MnO2+2H2O+2e- == 2MnOOH+2OH-。

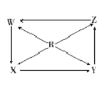
【题目】如图R、W、X、Y、Z为五种物质,若箭头表示能进一步转化的常见反应,则其中常温下能实现图示转化关系的是( )
选项 | R | W | X | Y | Z |
|
A | Si | SiO2 | H2SiO3 | NaSiO3 | SiCl4 | |
B | Na | Na2O | Na2O2 | Na2CO3 | NaOH | |
C | Fe | Fe(OH)2 | FeCl2 | FeCl3 | Fe(NO3)3 | |
D | Al | NaAlO2 | Al2(SO4)3 | AlCl3 | Al(NO3)3 |