题目内容
某含铬Cr2O72-废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3,其中Cr的化合价为+3价。不考虑处理过程中的实际损耗,下列叙述错误的是
| A.消耗硫酸亚铁铵的物质的量为n(2-x)mol |
B.处理废水中Cr2O72- 的物质的量为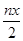 mol mol |
| C.反应中转移的电子为3nx mol |
| D.在FeO·FeyCrxO3中3x=y |
A
试题分析:A、根据铁元素守恒得,消耗硫酸亚铁铵的物质的量为n(y+1)mol,错误;B、根据铬元素守恒,沉淀中铬元素的物质的量为nx,所以处理废水中Cr2O72- 的物质的量为
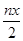 mol,正确;C、废水中Cr2O72-的化合价为+6价,反应后为+3价,所以反应中转移的电子为3×2×
mol,正确;C、废水中Cr2O72-的化合价为+6价,反应后为+3价,所以反应中转移的电子为3×2×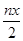 mol ="3nx" mol,正确;D、反应中铬得到电子为3nx mol,亚铁离子转化为铁离子失去nymol电子,根据得失电子守恒,有3nx=ny成立,所以3x=y,正确,答案选A。
mol ="3nx" mol,正确;D、反应中铬得到电子为3nx mol,亚铁离子转化为铁离子失去nymol电子,根据得失电子守恒,有3nx=ny成立,所以3x=y,正确,答案选A。
练习册系列答案
相关题目

 aTiCl4+cCO……反应①
aTiCl4+cCO……反应① Ti+2MgCl2……反应②
Ti+2MgCl2……反应②
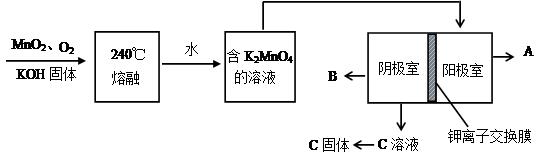
 ),聚丙烯酸钾单体的结构简式为 。
),聚丙烯酸钾单体的结构简式为 。