题目内容
2.8 g Fe全部溶于一定浓度、200 mL的HNO3溶液中,得到标准状况下的气体1.12 L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列有关判断正确的是( )。
| A.反应后溶液中c(NO3-)=0.85 mol·L-1 |
| B.反应后的溶液最多还能溶解1.82 g Fe |
| C.反应前HNO3溶液的浓度为1.0 mol·L-1 |
| D.1.12 L气体是NO、NO2的混合气体 |
AB
据题意,硝酸过量:0.2 L×0.1 mol·L-1=0.02 mol,反应生成Fe3+:2.8 g÷56 g·mol-1=0.05 mol,A项中据反应后溶液中的电荷守恒,得c(NO3-)=(0.05 mol×3+0.02 mol×1)÷0.2 L=0.85 mol·L-1,该项正确;B项中反应后的溶液还能与铁发生反应的离子方程式为:
3Fe + 8H+ + 2NO3-=3Fe2++2NO↑+4H2O
3 8 2
0.02 mol×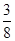 0.02 mol 0.17 mol(过量)
0.02 mol 0.17 mol(过量)
2Fe3+ + Fe = 3Fe2+
0.05 mol 0.025 mol
则最多能溶解铁:(0.02 mol×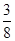 +0.025 mol)×56 g·mol-1=1.82 g,故该项正确;C项中据氮原子守恒,反应前HNO3溶液的浓度为(0.17 mol+1.12 L÷22.4 L·mol-1)÷0.2 L=1.1 mol·L-1,故该项错误;D项中反应前硝酸的溶液为稀溶液(c(HNO3)=1.1 mol·L-1),1.12 L气体应是NO气体,故该项错误。
+0.025 mol)×56 g·mol-1=1.82 g,故该项正确;C项中据氮原子守恒,反应前HNO3溶液的浓度为(0.17 mol+1.12 L÷22.4 L·mol-1)÷0.2 L=1.1 mol·L-1,故该项错误;D项中反应前硝酸的溶液为稀溶液(c(HNO3)=1.1 mol·L-1),1.12 L气体应是NO气体,故该项错误。
3Fe + 8H+ + 2NO3-=3Fe2++2NO↑+4H2O
3 8 2
0.02 mol×
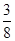 0.02 mol 0.17 mol(过量)
0.02 mol 0.17 mol(过量)2Fe3+ + Fe = 3Fe2+
0.05 mol 0.025 mol
则最多能溶解铁:(0.02 mol×
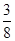 +0.025 mol)×56 g·mol-1=1.82 g,故该项正确;C项中据氮原子守恒,反应前HNO3溶液的浓度为(0.17 mol+1.12 L÷22.4 L·mol-1)÷0.2 L=1.1 mol·L-1,故该项错误;D项中反应前硝酸的溶液为稀溶液(c(HNO3)=1.1 mol·L-1),1.12 L气体应是NO气体,故该项错误。
+0.025 mol)×56 g·mol-1=1.82 g,故该项正确;C项中据氮原子守恒,反应前HNO3溶液的浓度为(0.17 mol+1.12 L÷22.4 L·mol-1)÷0.2 L=1.1 mol·L-1,故该项错误;D项中反应前硝酸的溶液为稀溶液(c(HNO3)=1.1 mol·L-1),1.12 L气体应是NO气体,故该项错误。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
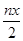 mol
mol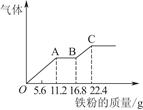
 mol
mol mol
mol L
L +
+ 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。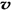 (N2)/
(N2)/  (O2)=2:3
(O2)=2:3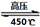 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。