题目内容
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是


| A.相对于途径①,途径②更好地体现了绿色化学思想 |
| B.Y可以是葡萄糖溶液 |
| C.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1 mol |
| D.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 |
C
试题分析:A.发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O,会产生大气污染物NO,而第二种方案的反应为2Cu+O2
 2CuO. CuO+ H2SO4=CuSO4+H2O。不会产生污染环境的物质。因此途径②更好地体现了绿色化学思想。正确。B.向CuSO4溶液中加入过量的NaOH溶液会产生Cu(OH)2悬浊液,然后再加入含有醛基的物质如葡萄糖、甲醛、甲酸等并加热煮沸,就会发生氧化还原反应得到砖红色的Cu2O沉淀。因此Y可以是葡萄糖溶液。正确。C. n(CuSO4)=16g÷160g/mol=0.1mol.根据物质在反应时的关系可知n(H2SO4)=0.1mol.但是硫酸发生的不是氧化还原反应。错误。D.途径①反应的两种方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,产生2mol的NO3-消耗2mol的硝酸,它同时提供2mol的H+。则8mol的H+中硫酸电离产生的H+的物质的量为6mol。因此小于消耗硫酸3mol。故n(H2SO4):n(HNO3)=3:2.正确。
2CuO. CuO+ H2SO4=CuSO4+H2O。不会产生污染环境的物质。因此途径②更好地体现了绿色化学思想。正确。B.向CuSO4溶液中加入过量的NaOH溶液会产生Cu(OH)2悬浊液,然后再加入含有醛基的物质如葡萄糖、甲醛、甲酸等并加热煮沸,就会发生氧化还原反应得到砖红色的Cu2O沉淀。因此Y可以是葡萄糖溶液。正确。C. n(CuSO4)=16g÷160g/mol=0.1mol.根据物质在反应时的关系可知n(H2SO4)=0.1mol.但是硫酸发生的不是氧化还原反应。错误。D.途径①反应的两种方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,产生2mol的NO3-消耗2mol的硝酸,它同时提供2mol的H+。则8mol的H+中硫酸电离产生的H+的物质的量为6mol。因此小于消耗硫酸3mol。故n(H2SO4):n(HNO3)=3:2.正确。
练习册系列答案
相关题目
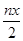 mol
mol 2LiH+2Al+3H2↑
2LiH+2Al+3H2↑ 2NO+HNO3+9HF,下列有关说法正确的是( )
2NO+HNO3+9HF,下列有关说法正确的是( )